流行病學
据《美国呼吸与重症监护医学杂志》报道,87%的美国外科手术患者在吸入麻醉后会出现肺不张,54%-67%的加拿大患者亦是如此。目前,发达国家开胸心脏外科手术后此类肺部并发症的发生率为15%,患者死亡率为18.5%,占外科手术并发症总死亡率的2.79%。
据世界卫生组织统计,过去20年来,全球早产儿数量持续上升。每年1260万新生儿中,早产儿(妊娠37周前出生)占9.6%。然而,这一数字在不同地区存在差异,非洲早产率最高(11.8%),欧洲最低(6.3%)。
在美国,新生儿呼吸窘迫综合征是婴儿死亡的五大原因之一,占婴儿死亡总数的5.6%。
先天性肺不张是造成3.4%新生儿死亡的原因。
肺不张在幼儿中也很常见,因为他们的气道较窄,许多结构仍在形成。
原因 肺部失气
并非所有类型的肺不张都由单一病因引起。因此,根据受累面积大小,部分性肺不张(局灶性、孤立性或节段性肺不张)以及完全性肺不张或肺塌陷可能存在不同的病因。
解释肺不张的发病机制时,需要回顾一下:支气管肺泡看起来像被结缔组织隔开的气泡,毛细血管网络贯穿其中,动脉血在其中进行氧合(即吸收吸入的氧气),静脉血在其中释放二氧化碳。肺不张会导致部分肺部通气中断,肺泡内空气的氧分压下降,从而导致肺循环气体交换中断。
肺科医生根据肺不张在气管结构中的位置特征(右肺不张、左肺不张、肺叶(下叶、中叶或上叶)不张)或根据其发病机制来确定肺不张的类型。因此,原发性肺不张(也称为先天性肺不张)发生在肺部开口异常的新生儿(尤其是早产儿);更多相关信息将在下文“新生儿肺不张”部分讨论。
所有其他病例均被视为继发性或获得性疾病,其中包括阻塞性或阻塞性肺不张和非阻塞性(包括压缩性和膨胀性肺不张)。
由于右肺中叶最窄且被大量淋巴组织包围,因此肺中叶肺不张被认为是最常见的。
阻塞性肺不张(大多数情况下是部分性)是由于胃食管反流病期间异物吸入呼吸道(阻塞空气通道)或肿块进入呼吸道而导致肺塌陷;阻塞性支气管炎、严重气管支气管炎、肺气肿、支气管扩张、急性和慢性嗜酸性肺炎和间质性肺炎、哮喘等期间粘液渗出物阻塞支气管而诊断的。
例如,当支气管被来自海绵状血管的血凝块或干酪样肿块阻塞时,最常发生结核病中的肺不张(通常是节段性的);此外,在结核病中,过度生长的肉芽肿组织会压迫细支气管组织。
无论完全阻塞性肺不张发生在何处,其各个阶段都会逐渐进展,导致患者病情迅速恶化——因为氧气、二氧化碳和氮气被“阻塞”的肺泡吸收,导致血气整体成分发生变化。
压迫性肺不张引起的肺组织功能障碍是由于肥大的淋巴结、增大的纤维性肿瘤、大型肿瘤、胸腔积液等压迫胸腔内外肺组织,导致肺泡塌陷。专科医生经常在肺癌、位于纵隔的胸腺瘤或淋巴瘤、支气管肺泡癌等疾病中观察到肺不张。
如果肺实质完全受损,可诊断为完全性肺不张和肺塌陷。当胸部创伤导致胸膜紧绷状态破裂,空气进入胸膜腔时,可发生张力性气胸,并伴有肺不张(但肺不张并非气胸的同义词)。
所谓盘状或板状肺不张是一种压缩性肺不张,它因在X射线图像上出现的阴影呈细长的横条纹状而得名。
膨胀性或功能性肺不张(最常见于节段性和亚节段性,位于下叶)的病因与延髓呼吸中枢神经元活动受到抑制有关(在脑损伤和肿瘤中,通过面罩或气管插管进行全身吸入麻醉);卧床患者膈肌功能下降;由于水肿和肠道气体形成增加导致腹腔压力升高。在第一种情况下,有医源性肺不张原因:在气管插管麻醉下,肺组织中的压力和气体吸收发生变化,导致肺泡塌陷。正如外科医生指出的那样,肺不张是各种腹部手术的常见并发症。
一些资料区分了收缩性肺不张(收缩),这是由于支气管痉挛、受伤、手术干预等期间肺泡尺寸减小和表面张力增加引起的。
肺不张可能是多种间质性肺疾病的症状,这些疾病会损害肺泡周围的组织:外源性过敏性肺泡炎(过敏性肺炎或尘肺)、肺结节病、闭塞性细支气管炎(隐源性肺炎)、脱屑性间质性肺炎、肺朗格汉斯组织细胞增生症、特发性肺纤维化等。
症狀 肺部失气
肺功能不全的最初迹象是吸气时呼吸短促和胸壁扩张减少。
如果病变仅影响肺部小面积,肺不张的症状较为轻微,仅限于缺氧和虚弱感。当病变严重时,患者面色苍白;鼻子、耳朵和指尖发青(紫绀);患侧出现刺痛(不常见)。肺不张伴有感染时,可能会出现发热和心率加快(心动过速)。
此外,肺不张的症状还包括:呼吸不规律、急促、浅;血压下降;手脚冰冷;体温下降;咳嗽(无痰)。
如果在支气管炎或支气管肺炎的背景下发生肺不张,且病变广泛,则所有症状会突然加剧,呼吸变得急促、浅而无律失常,常伴有喘息。
新生儿肺不张的症状包括喘息、呼气时呻吟、呼吸不规律伴有呼吸暂停、鼻孔张开、面部及全身皮肤发绀、吸气时肋骨间皮肤回缩(从肺不张发生侧来看)。还会出现脉搏加快、体温下降、肌肉僵硬和抽搐。
新生儿肺不张
新生儿肺不张或原发性肺不张是所谓的新生儿呼吸窘迫综合征(ICD-10 代码 - P28.0-P28.1)的主要原因。
先天性肺不张是由于羊水或胎粪吸入阻塞气道,导致肺和胸腔内压力升高,并损伤肺泡上皮而发生的。这种病变也可能是宫内肺和支气管组织发育不良(Wilson-Mikiti综合征)、支气管肺发育不良(胎龄小于32周出生的儿童)、先天性肺泡或肺泡毛细血管发育不良、宫内肺炎以及先天性表面活性物质分泌障碍所致。
后者在先天性肺不张的发病机制中尤为重要。正常情况下,肺泡壁不会粘连,这是因为肺泡基底膜的特殊细胞(II型肺泡细胞)会产生一种表面活性剂——一种具有表面活性(降低表面张力的能力)的蛋白质-磷脂物质,从内部覆盖肺泡壁。
胎儿肺表面活性物质的合成始于胚胎发育第20周后,而胎儿肺表面活性物质系统在出生后要到第35周后才能开始扩张。因此,胎儿发育的任何延迟或异常以及宫内缺氧都可能导致表面活性物质缺乏。此外,研究发现,这种疾病与表面活性蛋白SP-A、SP-B和SP-C基因突变之间存在联系。
临床观察发现,由于内源性表面活性物质缺乏,发育不良性播散性肺不张会伴随肺实质水肿、淋巴管壁过度拉伸、毛细血管通透性增加以及血液淤滞,最终导致急性缺氧和呼吸衰竭。
此外,早产儿、胎盘早剥、围产期窒息、孕妇糖尿病以及手术分娩引起的肺不张,可能是肺泡壁上存在纤维状透明蛋白凝固纤维的症状(透明膜综合征、肺透明变性、新生儿肺泡内透明变性或1型呼吸窘迫综合征)。足月婴儿和幼儿的肺不张可能是由诸如囊性纤维化等遗传性疾病引起的。
診斷 肺部失气
为了诊断肺不张,医生会记录所有不适症状,并用听诊器听诊患者肺部进行身体检查。
为了查明病因,需要进行血液检查——一般检查、生化检查、血液pH值和气体成分检查、纤维蛋白原检查、抗体(包括针对结核分枝杆菌的抗体)、类风湿因子等。
仪器诊断包括肺量测定(确定肺容量)和脉搏血氧测定(确定血氧饱和度水平)。
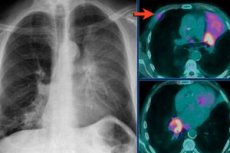
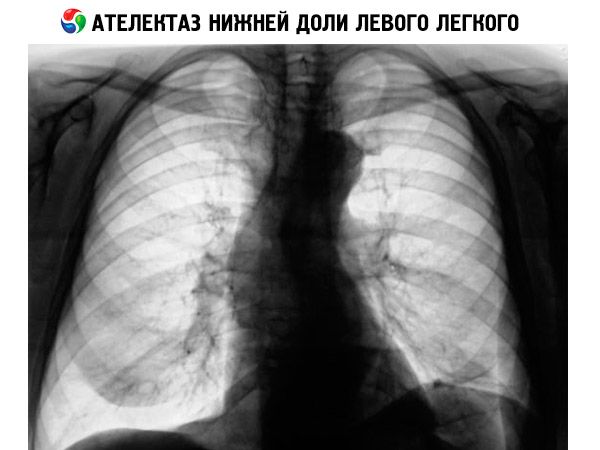
该病症的主要诊断方法是进行胸部近端-远端及侧位X光检查。肺不张X光检查可以检查胸腔器官的状况,并观察肺不张区域的阴影。图像可以清晰地显示气管、心脏和肺根本身的侧位偏移,以及肋间距和膈穹窿形状的变化。
高分辨率CT扫描可以检测肺不张:清晰地显示间质性肺疾病的细微细节。高分辨率CT图像有助于确诊特发性肺纤维化等疾病,从而避免进行肺活检。
支气管镜检查(将柔性支气管镜经口或鼻插入肺部)用于检查支气管并获取少量组织样本。支气管镜检查也用于治疗(见下文)。然而,如果需要从X光或CT扫描确定的特定区域获取更多肺组织进行组织学检查,则需要进行外科内镜活检。
需要檢查什麼?
鑑別診斷
对患者进行X射线检查时进行的鉴别诊断旨在将该病理与肺炎、支气管慢性炎症过程、结核感染引起的支气管狭窄、肺隔离症、囊性和肿瘤形成等区分开来。
治療 肺部失气
肺不张的治疗取决于其病因、持续时间和疾病的严重程度。
新生儿肺不张的治疗包括气管切开术(开放气道)、呼吸支持(正压呼吸)和吸氧。然而,长时间使用高浓度氧气会加重肺组织损伤,并可能导致早产儿发生肺后纤维增生。在大多数情况下,需要人工通气来确保动脉血液的氧合。
治疗新生儿肺不张的药物——表面活性剂替代品Infasurf、Survanta、Sukrim、Surfaxim——以相等的时间间隔注入儿童的气管,剂量根据体重计算。
如果肺不张是由气道阻塞引起的,则首先要消除阻塞原因。这可能需要使用电动吸引器或支气管镜检查去除血凝块(然后用消毒液冲洗支气管)。有时,体位性咳嗽引流即可:患者侧卧,头部低于胸部,咳嗽时所有阻塞气道的物质都会随咳嗽排出。
医生会开抗生素来对抗几乎总是伴随继发性阻塞性肺不张的感染——参见肺炎抗生素
对于卧床患者出现缺氧性肺不张,应进行物理治疗,包括恒压吸入氧气和二氧化碳混合气体;超高频治疗;药物电泳。呼吸体操(增加呼吸深度和节奏)对肺不张有积极作用,而治疗性按摩可加速渗出液排出。
如果肺不张的病因是肿瘤,则可能需要化疗、放疗和手术。如果肺部受累区域因坏死而必须切除,也可以进行手术。
据医生介绍,肺不张的紧急护理只能通过紧急住院进行。在医疗机构,患者会注射毒毛旋花苷、樟脑和皮质类固醇。为了刺激呼吸,可以使用呼吸兴奋剂类药物,例如烟酸二乙酰胺(尼西他胺)——肠外注射1-2毫升,每日最多三次;滴剂口服(每次20-30滴,每日两到三次);乙咪唑(片剂——每次50-100毫克,每日三次;1.5%溶液——皮下或肌肉注射)。这两种药物的副作用包括头晕、恶心、焦虑加剧和睡眠障碍。



 [
[