該文的醫學專家
新出版物
预防血栓形成和改善血液流变性的药物
最近審查:07.07.2025
在预防休克期间多个微血栓的形成及其破坏方面,可以采用各种药理学方法,使用防止血栓形成和改善血液流变性的药物:
- 使用血管活性药物和正性肌力药物消除全身血液动力学和微循环障碍;
- 采用合理的输液疗法和恢复红细胞膜弹性的药物(曲妥珠单抗或己酮可可碱)来改善血液流变性的措施;
- 预防血小板聚集和小动脉血管中初始“白色”血栓的形成,随后启动凝血级联;
- 抑制全身凝血级联激活后的血栓形成;
- 激活纤维蛋白溶解作用以溶解新形成的血凝块(纤维蛋白溶酶、链激酶、链球菌蛋白酶、尿激酶等),或者相反,当在某些患有创伤性休克和脓毒症的患者中全身性纤维蛋白溶解时抑制纤维蛋白溶解(氨基己酸、安必利、康力可等)。
列出的大多数方法都是传统的、在休克治疗实践中发展成熟的方法,具有各自的血液流变学指征,并在相关章节中进行了详细说明。因此,本节建议重点讨论使用影响血液凝固前期的药物预防休克血栓形成的一般方法。正是这种预防凝血并发症——“白色动脉血栓”的发生、形成和生长——的水平引起了研究人员的最大关注。
各种类型的休克都具有多种且通常多向性的凝血功能障碍,并伴有血液流变学的恶化。脓毒症、内毒素性、烧伤性、创伤性和出血性休克最典型的特征是最小血管内形成多个微血栓,其原因是全身血液动力学紊乱、血管痉挛和微循环障碍、血液粘稠、淤血、红细胞膜弹性下降,以及多种全身和局部因素(自身免疫性)引起的局部凝血、止血和凝血前期的改变。
以下以示意图(缩写)的形式介绍血液凝固的初始阶段和局部血液凝固稳态的机制。
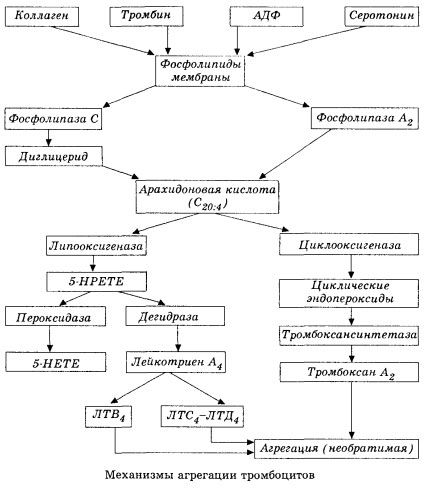
它始于膜磷脂酶A2的激活,这是由于多种损伤因素(直接膜损伤、缺氧、脂质过氧化、内源性化学因素等)共同作用的结果。膜磷脂分解导致非酯化的长链脂肪酸释放,其中花生四烯酸是最重要的初始底物。其转化(花生四烯酸级联)通过脂氧合酶(合成白三烯)和环氧合酶(合成前列腺素、血栓素、前列环素)途径进行。
由此产生的白三烯(B4、C4、E4、D4等)——这些具有极高生物活性的物质,包括缓慢反应的过敏性休克物质——在引发局部血管反应、炎症反应和免疫反应(包括自身免疫过程)中起着至关重要的作用。白三烯会导致微循环障碍,增加血液凝固,释放自溶性溶酶体酶,并向血液中释放一种抑制心肌收缩力和支气管痉挛的因子。
白三烯具有引起平滑肌收缩的作用,对全身血液动力学、冠状血管和心肌有显著影响,具有强大的冠状动脉收缩和负性肌力作用,伴随心输出量减少,在低血压的发生发展中起重要作用。
心输出量降低和白三烯引起的低血压反应与心肌衰弱和静脉回流受限有关。白三烯增加血管壁通透性并导致血浆外渗,在限制静脉回流方面发挥着重要作用。白三烯被认为在心肌梗死的发病机制中发挥了重要作用。
在过敏性休克和脓毒症(内毒素)休克中,它们的作用显然更为显著,这体现在过敏反应期间白三烯会在血浆中大量积聚,并引起过敏性休克特有的全身血流变化,以及白三烯受体阻滞剂和脂氧合酶抑制剂的保护作用。选择性白三烯受体阻滞剂的研发正在深入进行,是一个充满希望的科学方向。该领域已取得一些进展,并通过实验证实了此类阻滞剂在心肌缺血、内毒素和出血性休克中的有效性。然而,该方向的临床应用可能还需要几年时间。
如果说静脉血栓的形成是由血栓细胞和血浆凝血因子共同参与的,那么动脉血栓则是血栓形成的主要启动者。血栓细胞含有二磷酸腺苷 (ADP)、钙离子 (Ca2+)、血清素、磷脂、前列腺素和血栓素合成酶、血栓素(类似肌动球蛋白,赋予这些细胞收缩能力)、血管壁上皮细胞和肌肉细胞的血栓形成生长因子以及许多其他物质。血栓细胞功能的体液调节是通过其膜上的特异受体(α2 和 β2 肾上腺素受体、组胺和血清素受体、乙酰胆碱受体、血栓素受体、腺苷受体以及其他多种受体)进行的。血小板的一个特殊特性是对胶原蛋白和血管壁其他内皮下成分以及不润湿且带负电荷的表面具有高亲和力。这种特性使血小板具有极强的粘附(黏附)能力,能够粘附在内皮受损的血管壁上,而休克期间内皮受损的血管壁极易受损。在这种情况下,血小板会扩散并释放伪足,这些伪足可以相互粘附并粘附在血管壁上。膜通透性增加,吸附在血小板表面的二磷酸腺苷(ADP)、血清素、血栓素和一些凝血因子从血小板释放出来。这些物质与膜上相应的受体相互作用,并在钙离子的参与下引起聚集(最初是可逆的)。该过程在体液调节因子的促进下逐渐自我维持;相反,其他因素可以阻止甚至逆转这一过程,导致血小板解聚。
随着血栓形成影响和条件的占主导地位,粘附和可逆聚集阶段被第三阶段 - 不可逆聚集所取代,该阶段在血栓素的参与下进行并导致血栓收缩;在 Ca +,ATP 的参与下也发生聚集剂增强和收缩的反应,并导致白色血栓的形成。
花生四烯酸在血小板、血管内皮细胞和其他组织中的环氧合酶途径转化,确保了局部(代谢物的半衰期非常短)凝血稳态,因为在此代谢过程中会产生强大的促凝和抗凝物质。环氧合酶链式反应中激活血小板聚集的主要因子是血栓素A2,其同样强大的拮抗剂是由内皮细胞产生的前列环素,以及E和G系列前列腺素(作用较小)。此外,血小板聚集还受到其他局部和全身体液因素的强烈影响。
血小板聚集激活剂和抑制剂
血小板聚集的启动剂和激活剂 |
血小板聚集抑制剂 |
胶原 |
- |
ADP |
腺苷及其稳定剂 |
去甲肾上腺素(通过 α2 受体) |
α-肾上腺素能阻滞剂 |
血清素 |
抗血清素药物 |
组胺 |
抗组胺药 |
凝血酶 |
肝素 |
钙离子 |
Ca2+拮抗剂 |
CGMP - 其诱导剂(乙酰胆碱?)和稳定剂 |
CAM - 其诱导剂(通过β-肾上腺素受体)和稳定剂(磷酸二酯酶抑制剂) |
花生四烯酸 |
葡聚糖、白蛋白 |
血栓素A2 |
前列环素I2 |
在休克和心脏及脑部急性缺血过程中血栓形成的初始阶段进行药物干预表明了以下可能性:
- 抑制花生四烯酸级联的初始反应(全部和部分);
- 抑制血栓素合成的特定反应;
- 阻断血小板、平滑肌和其他细胞中的白三烯和血栓素受体;
- 使用调节血小板聚集的物质,即以其他方式削弱后者对启动因素(胶原蛋白,血栓素A2,白三烯等)影响的反应。
实施上述纠正血液流变性异常的方法,可以解决主要的策略性任务:保护血小板聚集和粘附受体免受激活剂的影响,或抑制这些受体的细胞内合成机制。抑制花生四烯酸级联的初始反应可以通过保护与聚合物激活剂反应的血小板受体来实现,使用低分子葡聚糖,其分子与纤维蛋白、胶原蛋白、聚集的免疫球蛋白(IgE)和补体系统成分竞争。
低分子葡聚糖通过遮蔽血小板膜上的受体,并与红细胞表面的大分子分散蛋白竞争,取代这些受体,破坏细胞间的连接。这是因为葡聚糖包裹血管内皮细胞和血细胞表面,增加了它们的负电荷,从而增强了抗聚集特性。
葡聚糖
低分子量葡聚糖能降低胶原和ADP诱导的血小板聚集,以及凝血酶对血小板的激活作用,抑制初始白色血小板血栓的生长,改善血流,减少术后血浆纤维蛋白原含量的升高,改变纤维蛋白的结构和稳定性。
创伤和休克患者静脉输注葡聚糖不仅可以降低血小板聚集和黏附,还能动员内源性肝素,从而促进形成松散且不易回缩的血凝块,而血凝块易被纤溶酶溶解。低分子葡聚糖的抗凝血酶活性与其对凝血因子VIII的结构和功能的特定影响有关。因子VIII(抗血友病球蛋白)是一种结构和功能复杂的大分子,参与血小板聚集及其形成的血凝块的稳定性。葡聚糖干扰因子VIII的作用,从而减缓血小板聚集并降低血凝块的稳定性。
低分子量葡聚糖不是真正的抗凝剂,其对血液流变性疾病的纠正作用主要与血液稀释、补充循环血浆量和改善微循环系统的血流有关。
葡聚糖在血液动力学紊乱(休克、失血)时改善血流的能力源于多种因素。该聚合物在血液中瞬间达到高浓度不仅会导致“直接血液稀释”,还会为液体从组织间隙流入血液创造条件,从而平衡葡聚糖的渗透作用。血液稀释的结果是血液粘度降低,流入心脏的静脉血流量增加,心输出量增加。除了这些作用外,葡聚糖还能与纤维蛋白原形成复合物,并具有抗血脂作用。
因此,低分子葡聚糖的抗凝作用和血流动力学效应有助于降低血液粘度,这在低剪切速率下尤为重要。血细胞的解聚可改善全身血流和微循环,尤其是在速度梯度最低的静脉部分。在各种类型的休克、损伤及其后果的外科治疗以及术后期间使用低分子葡聚糖溶液有助于预防高凝状态,并降低血栓形成和栓塞的可能性。
然而,需要注意的是,在某些情况下,输注葡聚糖溶液可能会引起过敏反应(如果出现致敏和过敏性休克,则可能存在危险)。这是因为葡聚糖分子量大且侧链多,可以作为抗原。因此,为了确定个体敏感性,建议预先静脉注射最多20毫升低分子量葡聚糖溶液作为半抗原(15%溶液,分子量1000),并在麻醉前输注血浆代用品。
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
凝血酶抑制剂
也可以使用与非聚合血小板激活剂竞争或抑制其的药物,对与血小板激活剂相互作用的血小板受体进行药理学保护。此类药物包括凝血酶抑制剂(肝素和水蛭素、多种合成抑制剂、肾上腺素拮抗剂)、α受体阻滞剂(酚妥拉明、二氢麦角胺)、ADP拮抗剂(双嘧达莫、腺苷及其结构类似物、磷酸肌酸)、5-羟色胺拮抗剂(麦角新碱)。上述药物中,只有少数实际用于预防和治疗各种原因引起的休克。
不同类型的药物可以保护与血小板聚集和粘附激活剂发生反应的蛋白质受体的细胞内合成机制,并抑制血栓素的合成过程:
- cATP、前列环素和前列腺素 PgE2 的诱导剂和稳定剂;
- 磷脂酶和磷酸二酯酶抑制剂。
特殊抗血小板药物的深入研发起步较晚,尚未取得可靠的结果。目前,临床实践中,除右旋糖酐溶液外,广泛使用乙酰水杨酸、吲哚美辛、双吡达莫、磺吡酮(潘生丁)、前列环素(依考前列酮)和肝素等抗血小板药物来预防白色血小板血栓的形成。
非甾体类抗炎药
非甾体类抗炎药(例如乙酰水杨酸和吲哚美辛)的药理作用已被证实源于其对二十烷酸(血栓素和前列腺素)代谢的影响。几乎所有此类药物都能够抑制前列腺素合成酶复合物,从而发挥其特异性的抗凝作用。
乙酰水杨酸口服后吸收非常快。其水解产物水杨酸可抑制血小板环氧合酶,从而阻止花生四烯酸转化为前列腺素O2,并最终转化为血栓素A2。乙酰水杨酸可抑制由胶原蛋白、ADP、肾上腺素和血清素诱导的血凝集。尽管其GG0 5为15分钟,但其抗凝作用可持续数天,这显然是由于其不可逆地抑制前列腺素合成反应,并在血小板整个生命周期(6-10天)内抑制聚集功能。大剂量乙酰水杨酸除了抑制血小板环氧合酶外,还会抑制血管壁的环氧合酶,并在抑制血栓素A2合成的同时,抑制内皮细胞中前列环素的合成。因此,应开小剂量(3000-5000 毫克/天)乙酰水杨酸作为抗凝剂,主要抑制血小板聚集。
鉴于乙酰水杨酸会抑制血小板环氧合酶数天,而抑制内皮细胞环氧合酶不超过一天,因此合理的做法不是每日服用,而是每3-4天服用一次。由于患者对该药物抗血小板作用的敏感性不同,因此应根据患者情况选择最佳乙酰水杨酸剂量。对于血小板反应性患者,0.5克乙酰水杨酸可抑制40-50%的血小板聚集;对于血小板高反应性患者,可完全抑制或抑制80-90%的血小板聚集;而对于血小板低反应性患者,相同剂量的乙酰水杨酸通常不产生抗血小板作用。
选择性血栓素合成酶抑制剂包括咪唑及其类似物,它们不阻断环氧合酶。双嘧达莫在临床上用作冠状动脉扩张剂,用于治疗慢性缺血性心脏病。它与咪唑一样,选择性抑制血栓素合成酶,阻止血栓素A2的合成。该药物及其类似物被认为也能抑制血小板磷酸二酯酶,从而增加血小板中cAMP的浓度。此外,双嘧达莫还能抑制腺苷脱氨酶的活性和血小板对腺苷的吸收,阻止血小板吸收血清素,并阻止肾上腺素和胶原蛋白诱导的血小板聚集。据报道,该药物具有较弱的抗血小板活性,但小剂量服用即可增强血小板聚集。双嘧达莫与乙酰水杨酸合用可达到最可靠的抗血小板效果。
肝素
在抗血栓药物中,最有效的血液聚集状态调节剂之一是肝素,尤其是在早期使用时。肝素具有高负电荷,能够与大分子和小分子离子(酶、激素、生物胺、血浆蛋白等)相互作用,因此其生物作用谱非常广泛。该药物具有抗凝血酶、抗凝血活酶和抗凝血酶原作用,可阻止纤维蛋白原转化为纤维蛋白,抑制血凝块回缩,并促进纤维蛋白溶解。
肝素的抗凝作用机制相当复杂。目前已确定肝素的抗凝作用与增强抗凝血酶III的作用以及增强肝素-抗凝血酶III复合物快速灭活凝血系统中大多数丝氨酸蛋白酶的能力有关。肝素的抗血栓作用中,其增加并维持血管内膜高负电势,从而防止血小板粘附和血小板微血栓形成的能力至关重要。肝素最积极地抑制静脉血栓形成,既能预防局部血栓形成,又能预防弥漫性血管内凝血。
前列环素及其稳定类似物
在抗血小板药物中,最强效的凝集抑制剂是前列环素及其稳定的类似物。前列环素的抗血小板作用是由于其刺激腺苷酸环化酶,从而导致血小板中 cAMP 浓度升高、血栓素含量降低、血栓素 A2 含量降低以及其受体阻断。前列环素不稳定,会迅速水解为无活性产物,因此需要静脉滴注给药,每次 2 至 20 ng/kg/min,每次 30-60 分钟,每日最多 6 次。
前列环素除了具有强大的抗凝作用外,还具有强大的血管扩张剂和支气管扩张剂作用。该药物可以扩张脑血管、心脏血管、肾脏血管、骨骼肌血管和肠系膜血管。在前列环素的作用下,冠状动脉血流量增加,心肌能量供应增加,耗氧量减少。尽管前列环素在体内不稳定,但其临床疗效可持续数周甚至数月。这种长期作用的机制尚不清楚。
前列环素是一种低毒药物,但使用前列环素可能引起副作用:面部潮红、头痛、血压下降、腹痛、厌食。与前列环素一样,其合成的稳定类似物(伊洛前列素等)也是很有前景的血小板聚集抑制剂。
改善血液粘度的药物
创伤和休克期间血液流变特性的紊乱不仅是由血小板功能活性的变化引起的,也是由血液粘度增加引起的。血液作为一个复杂的动态分散系统,其结构粘度很大程度上取决于血浆的粘度和红细胞的变形能力。血浆粘度主要取决于血液中蛋白质的浓度。小分子蛋白质(例如白蛋白)对血浆粘度影响不大,而大分子蛋白质(例如纤维蛋白原、α-球蛋白和γ-球蛋白以及其他大分子)会显著增加血浆粘度。
在低剪切速率下,纤维蛋白原和球蛋白在红细胞表面吸附,导致相邻细胞之间形成桥连,并形成红细胞聚集体。聚集体的形成速率是一个复杂的生物物理过程,不仅取决于剪切速率的大小,还取决于红细胞的电动力学特性、大分子聚集体的浓度、质量和吸附能力,以及红细胞的形状和可塑性。
维持红细胞膜的形状和机械特性需要大量的能量消耗。人们认为,红细胞在糖酵解过程中产生的能量被用于对频谱蛋白进行磷酸化,这会导致蛋白质二级结构的变化以及与内膜邻近成分的相互作用。膜的结构蛋白频谱蛋白和肌动蛋白之间的相互作用在红细胞膜机械特性的形成中起着重要作用,有助于在任何变形的情况下维持红细胞的表面积和厚度的恒定。
在全身血液动力学和器官血流障碍的情况下,红细胞膜僵硬性增加和红细胞聚集体的形成会导致红细胞通过毛细血管的速率降低,从而破坏血液的气体运输功能。因此,在休克时纠正血液流变性紊乱除了预防红细胞聚集外,还应包括恢复血浆和血液粘度、红细胞聚集和变形的正常化。
除低分子葡聚糖外,白蛋白溶液也是提高血液悬浮稳定性的有效方法之一。休克后期,在血浆白蛋白浓度下降、纤维蛋白原和球蛋白(尤其是α2组分)、脂蛋白和脂质浓度上升的背景下,红细胞会出现普遍聚集。在这些情况下,白蛋白的流变学效应主要源于两个因素:血液稀释和血浆中微球蛋白和巨球蛋白比例的正常化。同时,白蛋白会与游离酸结合,游离酸在创伤和休克期间的不稳定化会刺激血液细胞结构的聚集和血管内凝血,并可能导致脂肪栓塞。
旨在补充循环血量、消除组织缺氧和代谢性酸中毒的抗休克措施有助于恢复红细胞膜弹性,因为缺氧和酸中毒会显著降低红细胞的变形能力。休克时红细胞膜刚性增加可能与红细胞中ATP合成受抑制有关。反过来,ATP浓度降低会导致红细胞中Ca2+浓度升高,而Ca2+通过与膜蛋白结合,增加膜的刚性。
增加红细胞中 ATP 含量和红细胞膜弹性的药理药物之一是 Trental(己酮可可碱),在临床实践中用于治疗缺血性疾病。
除了降低红细胞膜的僵硬性之外,Trental 还会引起血管舒张,改善组织氧合,抑制组织中的磷酸二酯酶活性,增加 cAMP 浓度并抑制血小板聚集。
在维持红细胞膜弹性的其他药物中,值得注意的是 Ca2+ 拮抗剂,它可以限制离子流入红细胞(氟桂利嗪、硝苯地平等)。
 [ 19 ]、[ 20 ]、[ 21 ]、[ 22 ]、[ 23 ]、[ 24 ]、[ 25 ]、[ 26 ]、[ 27 ]
[ 19 ]、[ 20 ]、[ 21 ]、[ 22 ]、[ 23 ]、[ 24 ]、[ 25 ]、[ 26 ]、[ 27 ]
注意!
為了簡化對信息的理解,本指令使用了藥物 "预防血栓形成和改善血液流变性的药物",並根據藥物的醫療用途官方說明。 使用前請閱讀直接用於藥物的註釋。
描述僅供參考,不適用於自我修復指導。 這種藥物的需求,治療方案的目的,藥物的方法和劑量僅由主治醫師確定。 自我藥療對你的健康有危害。


