人体免疫缺陷病毒(HIV)
最近審查:04.07.2025
1981年,美国将获得性免疫缺陷综合征(AIM)认定为一种特殊疾病。当时,一些年轻人患上了由对健康人无致病性或致病性较弱的微生物引起的严重疾病。对患者免疫状况的研究表明,淋巴细胞数量总体急剧下降,尤其是T辅助细胞数量下降。这种疾病被称为艾滋病(AIDS)。感染途径(性接触、血液及其制剂)表明了该疾病的传染性。
艾滋病的病原体是1983年由法国人L. Montagnier独立发现的,他将其命名为LAV淋巴结病相关病毒,因为他是在患有淋巴结病的患者身上发现的;美国人R. Gallo将该病毒命名为HTLV-III(人类T淋巴细胞病毒III):他之前已经发现了淋巴细胞病毒I和II。
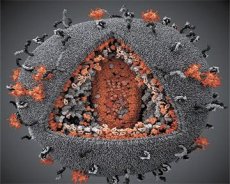
通过对LAV与HTLV-III病毒特性的比较,可以辨别它们的身份,为了避免混淆,1986年将该病毒命名为HIV(人类免疫缺陷病毒,简称HIV)。HIV呈球形,直径110纳米。病毒包膜呈多面体,由12个五边形和20个六边形组成。每个六边形的中心和角上都有一个糖基化蛋白gpl20分子(120表示该蛋白的分子量,单位为千道尔顿)。病毒体表面共有72个gpl20分子,呈奇特的刺突状,每个刺突都与膜内蛋白gp41相连。这些蛋白与双层脂质层一起,构成了病毒体的超衣壳(膜)。
Gpl20 和 gp41 蛋白是由细胞蛋白酶切割包膜前体蛋白而形成的。gp41 蛋白通过其胞质结构域与位于包膜正下方的基质蛋白 p17MA 结合,形成刺突“茎”。p17 分子在病毒体成熟过程中相互作用,形成包膜下方的二十面体。
在病毒体的中心部分,p24蛋白形成一个锥形衣壳。衣壳的狭窄部分在rb蛋白的参与下与病毒体膜相连。衣壳内部包含两个相同的病毒基因组RNA分子。它们通过5'端与核衣壳蛋白p7NC相连。该蛋白的有趣之处在于它包含两个富含半胱氨酸和组氨酸的氨基酸残基(基序),并含有一个锌原子——它们被称为“锌指”,因为它们能够捕获基因组RNA分子并将其纳入正在形成的病毒体中。衣壳还包含三种酶。逆转录酶(RT)或聚合酶复合物,包括逆转录酶、核糖核酸酶H和DNA依赖性DNA聚合酶。逆转录酶以异二聚体p66/p51的形式存在。蛋白酶(PR)- p10,启动并实施病毒体成熟过程。整合酶 (IN) - p31,又称核酸内切酶,确保前病毒DNA被整合到宿主细胞基因组中。衣壳还含有一个引物RNA分子(tRNA1"3)。
细胞内的RNA基因组在逆转录酶的帮助下转化为DNA基因组(DNA原病毒),该基因组由9283个核苷酸对组成。其左右两侧分别被所谓的长末端重复序列(LTR)所包围:左侧为S'-LTR,右侧为3'-LTR。每个LTR包含638个核苷酸对。
HIV基因组由9个基因组成,其中一些基因末端重叠(具有多个阅读框架),并具有外显子结构。它们控制9种结构蛋白和6种调节蛋白的合成。
LTR 对于病毒基因组的重要性在于它们含有以下控制其功能的调控元件:
- 转录信号(启动子区);
- poly-A 附加信号;
- 封盖信号;
- 积分信号;
- 正调控信号(TAT 蛋白的 TAR);
- 负调控元件(NEF 蛋白的 NRE)
- 3' 端为负链 DNA 合成提供引物 RNA(tRNA™3)的附着位点;LTR 5' 端为正链 DNA 合成提供引物的信号。
此外,LTR 还包含参与调节 mRNA 剪接、将 vRNA 分子包装到衣壳中的元件(Psi 元件)。最后,在基因组转录过程中,长 mRNA 中会形成两个信号,用于控制 REV 蛋白的合成:CAR(用于调节蛋白)和 CRS(用于结构蛋白)。如果 REV 蛋白与 CAR 结合,则合成结构蛋白;如果 REV 蛋白缺失,则仅合成调节蛋白。
以下调控基因及其蛋白质在调节病毒基因组功能方面发挥着特别重要的作用:
- TAT蛋白,对病毒复制进行正向调控,通过TAR调控区发挥作用;
- NEV 和 VPU 蛋白,通过 NRE 区域对复制发挥负面控制作用;
- REV蛋白,起正负调控作用。REV蛋白控制gag、pol、env基因的作用,对剪接起负调控作用。
因此,HIV 复制受到三重控制——阳性、阴性和阳性-阴性。
VIF蛋白决定了新合成病毒的传染性。它与p24衣壳蛋白结合,在病毒体中约有60个分子。NEF蛋白在病毒体中含量较少(5-10个),可能与包膜蛋白结合。
VPR蛋白抑制细胞周期于G2期,参与将整合前复合物转运至细胞核,激活某些病毒和细胞基因,并提高病毒在单核细胞和巨噬细胞中的复制效率。VPR、TAT、REV和VPU蛋白在病毒体中的定位尚未确定。
病毒体膜除自身蛋白质外,还可能含有一些宿主细胞的蛋白质。VPU和VPR蛋白参与病毒繁殖的调控。
人类免疫缺陷病毒(HIV)的抗原变体
人类免疫缺陷病毒(HIV)变异性极强。即使从同一患者体内,也能分离出抗原特性差异显著的病毒株。这种变异性是由于CD4+细胞的大量破坏和对HIV感染的强烈抗体反应所致。一种新的HIV病毒——HIV-2,在生物学特性上与HIV-1接近,但在免疫学上有所不同,已从西非患者体内分离出来。这些病毒基因组一级结构的同源性为42%。HIV-2的DNA原病毒包含9671bp,其长末端重复序列(LTR)为854bp。随后,HIV-2在世界其他地区被分离出来。HIV-1和HIV-2之间没有交叉免疫。已知HIV-1有两种主要类型:O型(异常型)和M型(主要型),后者又分为10个亚型(AJ)。俄罗斯有8个亚型(AH)。
 [ 1 ]、[ 2 ]、[ 3 ]、[ 4 ]、[ 5 ]、[ 6 ]、[ 7 ]、[ 8 ]、[ 9 ]、[ 10 ]
[ 1 ]、[ 2 ]、[ 3 ]、[ 4 ]、[ 5 ]、[ 6 ]、[ 7 ]、[ 8 ]、[ 9 ]、[ 10 ]
HIV与细胞相互作用的机制
病毒侵入人体后,首先攻击含有其特有CD4受体的细胞。这种受体在T辅助细胞中含量丰富,在巨噬细胞和单核细胞中含量较少,而T辅助细胞对病毒尤其敏感。
人类免疫缺陷病毒 (HIV) 利用其 gpl20 蛋白识别 CD4 受体。HIV 与细胞相互作用的过程遵循以下路径:受体介导的吸附 -> 包被小窝 -> 包被囊泡 -> 溶酶体。其中,病毒体膜与溶酶体膜融合,从超衣壳中释放出来的核衣壳进入细胞质;在进入细胞核的途中,核衣壳被破坏,基因组 RNA 及其相关核心成分被释放。随后,逆转录酶在病毒体 RNA 上合成 DNA 负链,随后 RNase H 破坏病毒体 RNA,病毒 DNA 聚合酶合成 DNA 正链。5'-LTR 和 3'-LTR 形成于 DNA 原病毒的末端。 DNA原病毒可以以非活性形式在细胞核中停留一段时间,但迟早会在整合酶的帮助下整合到靶细胞的染色体中。在靶细胞中,原病毒保持非活性状态,直到特定的T淋巴细胞被微生物抗原或其他免疫活性细胞激活。细胞DNA转录的激活受一种特殊的核因子(NF-kB)调控。它是一种DNA结合蛋白,在T淋巴细胞和单核细胞的激活和增殖过程中大量产生。该蛋白与细胞DNA的某些序列以及DNA原病毒的类似LTR序列结合,并诱导细胞DNA和DNA原病毒的转录。通过诱导DNA原病毒的转录,它使病毒从非活性状态转变为活性状态,从而从持续感染转变为有效感染。原病毒可以长时间保持非活性状态。病毒的激活是其与细胞相互作用的关键时刻。
从病毒侵入细胞的那一刻起,HIV感染期就开始了——病毒携带状态,可持续10年或更长时间;而从病毒被激活的那一刻起,疾病就开始了——艾滋病。在其调控基因及其产物的帮助下,病毒开始活跃地繁殖。TAT蛋白可以使病毒的繁殖速度提高1000倍。病毒转录过程非常复杂,包括全长和亚基因组mRNA的形成、mRNA剪接,以及结构蛋白和调控蛋白的合成。
结构蛋白的合成如下。首先,合成Pr55Gag前体多聚蛋白(分子量为55 kDa的蛋白质)。它包含4个主要结构域:基质(MA)、衣壳(CA)、核衣壳(NC)和rb结构域。病毒蛋白酶将Pr55Gag切割(它是从另一个前体蛋白Gag-Pol自身切割而来),由此分别形成结构蛋白p17、p24、p7和rb。Pr55Gag多聚蛋白的形成是病毒颗粒形成的主要条件。正是这种蛋白质决定了病毒粒子的形态发生程序。它依次包括Gag多聚蛋白向质膜的运输、与质膜的相互作用以及病毒颗粒形成和出芽过程中的蛋白质-蛋白质相互作用等阶段。Pr55Gag在游离多核糖体上合成;蛋白质分子被运输到膜上,并由其疏水区锚定。CA结构域在形成Gag蛋白的天然构象中起主要作用。NC结构域在其“锌指”的帮助下,确保将两个基因组RNA分子纳入正在形成的病毒颗粒的组成中。由于基质结构域的相互作用,多聚蛋白分子最初发生二聚化。然后,由于CA和NC结构域的相互作用,二聚体结合形成六聚体(由6个单元组成)。最终,六聚体在其侧面连接形成未成熟的球形病毒体,病毒基因组RNA被NC结构域捕获并包含在病毒体中。
另一种前体蛋白Prl60Gag-Pol(分子量为160 kDa)是在gag基因3'端翻译过程中,核糖体在rb蛋白编码区域上游区域发生移码而合成的。该Gag-Pol多聚蛋白包含不完整的Gag蛋白序列(1-423个氨基酸)和包含PR、RT和IN结构域的Pol序列。Gag-Pol多聚蛋白分子也在游离多聚核糖体上合成,并被运输至质膜。Prl60Gagpol多聚蛋白包含Gag多聚蛋白固有的所有分子间相互作用位点和膜结合位点。因此,Gag-Pol多聚蛋白分子与膜融合,并与Gag分子一起被纳入正在形成的病毒体,从而产生活性蛋白酶并启动病毒体成熟过程。 HIV-1蛋白酶仅在二聚体形式下才具有高活性,因此,为了从Prl60Gag-Pol上自我切除,需要这些分子二聚化。病毒体成熟包括:释放的活性蛋白酶在其识别的位点切割prl60Gag-Pol和Gag55;形成蛋白质p17、p24、p7、p6、逆转录酶和整合酶,并将它们结合到病毒结构中。
Env蛋白在内质网膜上的核糖体上合成,然后被糖基化,被细胞蛋白酶切割成gp120和gp41,并被运输到细胞表面。在这种情况下,gp41穿透细胞膜并与细胞膜内表面的Gag蛋白分子的基质结构域结合。这种连接在成熟病毒体中得以保留。
因此,病毒颗粒的组装包括前体蛋白和相关RNA分子在宿主细胞质膜上的聚集、未成熟病毒体的形成以及它们通过出芽从细胞表面释放的过程。在出芽过程中,病毒体被一层细胞膜包裹,gp41和gp120分子嵌入其中。在出芽过程中,或者可能在病毒体释放后,病毒体会进行成熟。这一过程在病毒蛋白酶的帮助下进行,包括将前体蛋白Pr55Gag和Prl60Gag-Pol水解切割成成熟病毒的蛋白质,并将其结合成特定的结构复合物。前体多聚蛋白Pr55Gag在病毒形态发生过程中起主导作用,它负责组织和组装未成熟的病毒体;病毒体的成熟过程由一种特定的病毒蛋白酶完成。
免疫缺陷的原因
HIV感染导致免疫缺陷的主要原因之一是T辅助细胞的大量死亡。其发生由以下事件引起。首先,感染病毒的T辅助细胞因凋亡而死亡。据信,在艾滋病患者中,病毒复制、凋亡和T辅助细胞数量的减少是相互关联的。其次,T杀伤细胞识别并破坏感染病毒或携带吸附的gpl20分子的T细胞,以及病毒感染和未感染病毒的T辅助细胞,这些T辅助细胞形成由数十个细胞组成的共质体(合胞体),其中一些细胞因病毒在其中繁殖而死亡。由于大量T辅助细胞的破坏,B淋巴细胞膜受体对白细胞介素-2的表达减少,各种白细胞介素(B淋巴细胞生长和分化因子-IL-4、IL-5、IL-6等)的合成受到干扰,导致T杀伤系统功能紊乱。补体和巨噬细胞系统的活性受到抑制。感染病毒的巨噬细胞和单核细胞在较长时间内不会死亡,但它们无法将病毒从体内清除。最后,由于gpl20与人体某些上皮细胞受体(包括介导HIV移植传播的滋养层受体)的结构和抗原相似性,因此会合成具有广谱作用的抗受体抗体。此类抗体能够阻断各种细胞受体,并使自身免疫性疾病的病程复杂化。 HIV 感染的后果是免疫系统所有主要环节的崩溃。这些患者对多种微生物失去防御能力。这导致机会性感染和肿瘤的发生。HIV 感染患者罹患至少三种癌症的风险增加:卡波西肉瘤;癌(包括皮肤癌);B 细胞淋巴瘤,其由 B 淋巴细胞的恶性转化引起。然而,HIV 不仅具有嗜淋巴细胞性,还具有嗜神经性。它通过受体介导的内吞作用以及星形胶质细胞吞噬病毒感染的淋巴母细胞的方式进入中枢神经系统细胞(星形胶质细胞)。当病毒与星形胶质细胞相互作用时,还会形成共质体,从而促进病原体通过细胞间通道传播。病毒可以在巨噬细胞和单核细胞中长期存活,因此它们作为病毒在体内的储存器和分配器,能够穿透所有组织。受感染的巨噬细胞在HIV进入中枢神经系统并造成损害的过程中起着重要作用。10%的患者的主要临床症状与中枢神经系统损害有关,并表现为痴呆症。因此,HIV感染者的特征是三类疾病:机会性感染、肿瘤疾病和中枢神经系统损害。
HIV感染的流行病学
HIV 的感染源仅仅是人——病人或病毒携带者。人类免疫缺陷病毒 (HIV) 存在于血液、精液和宫颈液中;哺乳期母亲的乳汁中也含有 HIV。HIV 的感染途径包括性接触、血液及其制剂,以及产前、产中和产后母婴传播。目前尚无通过食物、饮料和昆虫叮咬感染 HIV 的病例。
吸毒成瘾助长了艾滋病的蔓延。艾滋病毒的发病率逐年上升。据世界卫生组织统计,1980年至2000年,全球共有5800万人感染艾滋病毒。仅在2000年,全球就有530万人感染,300万人死于艾滋病。截至2004年1月1日,俄罗斯登记的艾滋病毒感染者有26.4万人。一半的艾滋病毒感染者在感染后11至12年内死亡。2004年初,每10万俄罗斯公民中约有180人被诊断为“艾滋病毒感染者”。预计按照这样的发病率,到2012年,俄罗斯的艾滋病毒感染者总数将达到250万至300万人。抗击艾滋病毒感染的复杂性取决于以下几个原因:首先,目前缺乏有效的治疗方法和具体的预防措施;其次,HIV感染的潜伏期可能超过10年。其持续时间取决于T淋巴细胞及其染色体中所含DNA原病毒的激活时间。目前尚不清楚所有感染该病毒的人是否都会患上艾滋病,或者长期携带病毒而不发病的可能性是否可能(这似乎不太可能)。最后,存在几种人类免疫缺陷病毒(HIV-1和HIV-2),它们之间的抗原差异阻碍了交叉免疫的形成。猿猴免疫缺陷病毒(SIV)的发现为HIV的起源问题提供了线索。SIV的基因组结构与HIV相似,但核苷酸序列存在显著差异。HIV-2的血清学特性介于HIV-1和SIV之间,核苷酸序列也更接近SIV。在这方面,VM Zhdanov认为HIV-1、HIV-2和SIV病毒起源于共同的祖先。根据 R. Gallo 的说法,有可能其中一种 SIV 以某种方式进入人体,并发生一系列突变,导致 HIV-1、HIV-2 及其其他形式的出现。
HIV感染的症状
人类免疫缺陷病毒(HIV)的一些特征在很大程度上决定了该疾病的发病机制。该病毒具有极高的繁殖率,这由其调控元件决定(在活跃期,5分钟内最多可合成5,000个病毒体)。由于融合蛋白(gp41)的存在,该病毒会诱导感染和未感染的T辅助细胞融合形成广泛的合胞体结构,从而导致其大量死亡。大量形成的gpl20蛋白分子在血液中自由循环,并与未感染T辅助细胞的受体结合,因此它们也会被T杀伤细胞识别和摧毁。该病毒可以通过细胞间通道在细胞之间传播,在这种情况下,抗体难以接近它。
HIV感染的临床标准
成人感染艾滋病毒时,需同时出现至少两种严重症状和至少一种轻微症状,且无其他已知免疫缺陷病因(例如癌症、先天性免疫缺陷、严重饥饿等),方可确诊。严重症状包括:
- 体重减轻10%或更多;
- 长期发热,间歇性或持续性;
- 慢性腹泻。
轻微症状:持续咳嗽、全身性皮炎、复发性带状疱疹、口腔和咽部念珠菌病、慢性单纯疱疹、全身淋巴结肿大。仅存在卡波西肉瘤、隐球菌性脑膜炎、肺孢子菌性肺炎即可诊断为艾滋病。该病的临床表现受伴随的机会性感染影响。
人类免疫缺陷病毒(HIV)的培养方法
HIV-1 和 HIV-2 只能在从白血病 TCV4 淋巴细胞中获得的 TCV4 淋巴细胞克隆 H9 的细胞中培养。HIV-1 在其中良好繁殖的星形胶质细胞单层培养物也可用于此目的。在动物中,黑猩猩对 HIV-1 较为易感。
病毒在外界环境中的抵抗力较低。在阳光和紫外线照射下会死亡,在80°C下30分钟内即可被杀灭,而用常用消毒剂处理则需20-30分钟。对含病毒材料进行消毒时,必须使用杀分枝杆菌的消毒剂,因为它们对抵抗力最高的微生物有效。
HIV感染的实验室诊断
诊断病毒携带和HIV感染的主要方法是酶联免疫吸附试验(ELISA)。然而,由于gpl20与某些人体细胞的受体(包括通过粘膜上皮细胞转运免疫球蛋白的受体)在结构和抗原上具有相似性,因此体内可能出现与抗gpl20抗体相关的抗体。在这种情况下,可能会出现ELISA假阳性结果。因此,所有呈阳性反应的受试者血清均需使用免疫印迹法(Western blotting)进行额外分析。该方法基于在电泳分离待测抗体后进行鉴定,然后使用标记的抗物种抗体进行检测。由于病毒培养的复杂性,病毒学方法很少使用。H9淋巴细胞克隆可用于获取病毒抗原——诊断检测系统的必要组成部分。CPR方法可以在病毒血症的早期阶段检测出病毒。
HIV感染的治疗
有必要寻找或合成能够有效抑制逆转录酶(逆转录酶)或病毒蛋白酶活性的药物。这些药物可以阻止DNA原病毒的形成和(或)抑制病毒在细胞内的复制。现代HIV感染者的治疗策略基于联合使用抑制病毒蛋白酶(一种药物)和逆转录酶(两种不同的药物)的药物——联合(三联)疗法。在俄罗斯,对于HIV感染者的治疗,建议联合使用两种国产药物:磷嗪和克立昔凡,它们可以特异性地抑制HIV在早期和晚期的复制,尤其是在降低叠氮胸苷活性的情况下。
特异性预防的关键在于需要研制一种疫苗,确保基于病毒特异性细胞毒性淋巴细胞(Thl辅助细胞)形成有效的细胞介导免疫,且不会产生大量抗体。这种免疫力由Thl辅助细胞提供。抗体(包括病毒中和抗体)可能不仅无法有效抑制HIV感染,而且在很大程度上会抑制细胞介导免疫。因此,抗HIV疫苗首先必须满足两个主要要求:a) 绝对安全;b) 刺激T细胞毒性淋巴细胞的活性。目前正在研究从灭活病毒和具有高保护性的单个抗原中获得的各种疫苗变体的有效性。这些抗原可以从病毒体本身分离,也可以通过化学合成。一种基于基因工程方法的疫苗已被提出。它是一种携带HIV基因的重组痘苗病毒,该基因负责合成具有强免疫原性的抗原。由于HIV感染潜伏期长、病原体变异性强,这些疫苗的有效性问题需要相当长的时间才能得到解决。研制高效的HIV疫苗是一个亟待解决的根本问题。


