呼吸支气管
最近審查:04.07.2025
随着支气管口径的减小,其管壁变薄,上皮细胞的高度和行数减少。非软骨性(或膜性)细支气管的直径为1-3毫米,上皮中没有杯状细胞,其作用由克拉拉细胞承担,无明显边界的粘膜下层延伸至外膜。膜性细支气管延伸至直径约0.7毫米的终末细支气管,其上皮为单排。直径为0.6毫米的呼吸性细支气管从终末细支气管分支出来。呼吸性细支气管通过毛孔与肺泡相连。终末细支气管是导气的,呼吸性细支气管参与气体传导和气体交换。
终末呼吸道的总横截面积比气管和大支气管的横截面积大很多倍(53-186 cm² vs 7-14 cm² ),但细支气管仅占气流阻力的20%。由于终末呼吸道阻力较低,早期细支气管损伤可能无症状,不伴有功能检查的改变,并且可能是高分辨率CT扫描的偶然发现。
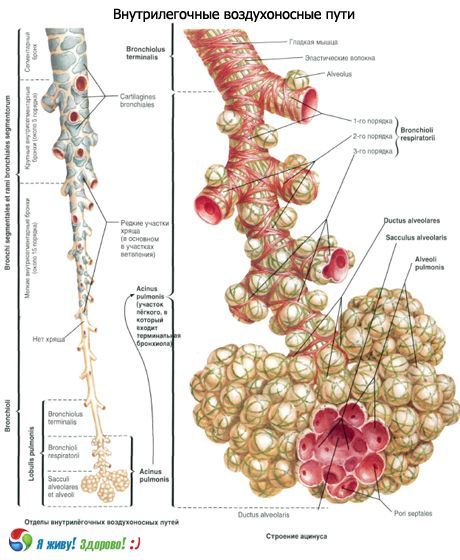
根据国际组织学分类,终末细支气管的分支集合被称为原发性肺小叶,或称腺泡。这是肺中数量最多的结构,气体交换在此进行。每个肺泡有15万个腺泡。成人的腺泡直径为7-8毫米,并包含一个或多个呼吸性细支气管。次级肺小叶是肺的最小单位,由结缔组织隔膜分隔。次级肺小叶由3至24个腺泡组成。其中央部分包含一个肺细支气管和一个动脉。它们被称为小叶核或“中心小叶结构”。次级肺小叶由小叶间隔隔开,小叶核内包含静脉和淋巴管、动脉和细支气管分支。次级肺小叶通常呈多边形,各边长度为1-2.5cm。
小叶的结缔组织框架由小叶间隔、小叶内间质、小叶中心间质、支气管血管周围间质和胸膜下间质组成。
终末细支气管分为14-16个一级呼吸细支气管,每个一级呼吸细支气管又分为二叉状的二级呼吸细支气管,二级呼吸细支气管又分为三级呼吸细支气管。每个三级呼吸细支气管又细分为肺泡管(直径100微米)。每个肺泡管末端有两个肺泡囊。
肺泡通道和肺泡的壁上有一些突起(气泡),即肺泡。每个肺泡通道约有20个肺泡。肺泡总数达6亿至7亿个,呼气时总面积约为40平方米,吸气时总面积约为120平方米。
呼吸性细支气管上皮中,纤毛细胞数量逐渐减少,无纤毛立方细胞和克拉拉细胞数量增加。肺泡管内壁为鳞状上皮。
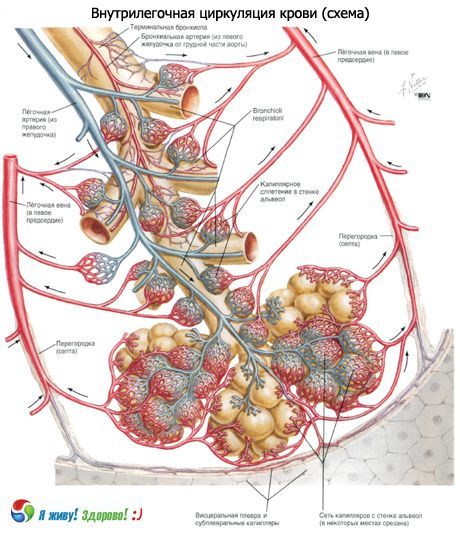
电子显微镜研究对现代人对肺泡结构的理解做出了重要贡献。肺泡壁在很大范围内是两个相邻肺泡的共同壁。肺泡上皮覆盖肺泡壁的两侧。在两层上皮之间有一个间质,其中有隔腔和毛细血管网络。隔腔内含有细胶原纤维束、网状纤维和弹性纤维、少量成纤维细胞和游离细胞(组织细胞、淋巴细胞、中性粒细胞)。毛细血管的上皮和内皮均位于 0.05-0.1 μm 厚的基底膜上。在一些地方,上皮下膜和内皮下膜被隔腔隔开,在另一些地方,它们接触,形成单一的肺泡-毛细血管膜。因此,肺泡上皮、肺泡毛细血管膜和内皮细胞层是气血屏障的组成部分,气体交换通过气血屏障进行。
肺泡上皮是异质性的;其中可区分出三种类型的细胞。I型肺泡细胞(肺泡细胞)覆盖肺泡的大部分表面。气体交换通过这些细胞进行。
II型肺泡细胞(肺泡细胞)或大型肺泡细胞呈圆形,伸入肺泡腔内。其表面有微绒毛。细胞质含有大量线粒体、发达的颗粒状内质网和其他细胞器,其中最典型的是膜结合的嗜锇层状体。它们由一种电子致密的层状物质组成,该物质含有磷脂以及蛋白质和碳水化合物成分。与分泌颗粒类似,层状体从细胞中释放出来,形成一层约0.05微米厚的表面活性剂薄膜,可降低表面张力,防止肺泡塌陷。
III型肺泡细胞,又称刷状细胞,其特征是顶端表面存在短微绒毛,胞质内有大量囊泡,并有成束的微纤维。它们被认为具有液体吸收、表面活性剂浓缩或化学感受的功能。Romanova LK(1984)提出了它们的神经分泌功能。
肺泡腔内通常存在少量巨噬细胞,负责吸收灰尘等颗粒物。目前,已明确肺泡巨噬细胞来源于血液单核细胞和组织细胞。
平滑肌收缩会导致肺泡底部缩小,气泡形状发生改变——气泡变长。正是这些变化,而不是隔膜破裂,导致了肿胀和肺气肿。
肺泡的形状取决于其壁的弹性,胸腔容积的增加会拉伸肺泡壁,而细支气管平滑肌的主动收缩又会拉伸肺泡壁。因此,在呼吸量相同的情况下,不同段的肺泡可能会有不同的拉伸程度。决定肺泡形状和稳定性的第三个因素是两种环境边界上形成的表面张力:充满肺泡的空气和覆盖肺泡内表面、保护上皮免于干燥的液膜。
为了抵消倾向于压缩肺泡的表面张力 (T),需要一定的压力 (P)。P 值与表面的曲率半径成反比,由拉普拉斯方程得出:P = T / R。由此可见,表面的曲率半径越小,维持给定体积的肺泡(在恒定 T 下)所需的压力就越大。然而,计算表明,该压力应该比实际存在的肺泡内压力高出许多倍。例如,在呼气过程中,肺泡应该塌陷,但这不会发生,因为低体积时肺泡的稳定性是由表面活性物质 - 表面活性剂保证的,当肺泡面积减小时,表面活性剂会降低膜的表面张力。这就是所谓的抗肺不张因子,由 Pattle 于 1955 年发现,由蛋白质-碳水化合物-脂质复合物组成,其中包括大量卵磷脂和其他磷脂。表面活性物质由呼吸段的肺泡细胞产生,肺泡细胞与表面上皮细胞一起从内部排列在肺泡内。肺泡细胞含有丰富的细胞器,其原生质中含有大型线粒体,因此以高活性的氧化酶为特征,还含有非特异性酯酶、碱性磷酸酶和脂肪酶。最令人感兴趣的是通过电子显微镜确定这些细胞中不断发现的内含物。这些是椭圆形的嗜锇体,直径为 2-10 μm,具有层状结构,由单层膜限制。
肺表面活性物质系统
肺的表面活性物质系统发挥着多种重要功能。肺的表面活性物质可以降低表面张力和肺通气所需的功,稳定肺泡并防止肺不张。在这种情况下,表面张力在吸气时增加,在呼气时降低,在呼气结束时接近于零。表面活性物质通过在吸气时肺泡体积减小时立即降低表面张力,并在吸气时肺泡体积增大时增加表面张力来稳定肺泡。
表面活性剂也为各种大小的肺泡的生存创造了条件。如果没有表面活性剂,小肺泡就会塌陷,并将空气输送到较大的肺泡。最小气道的表面也覆盖着表面活性剂,确保其通畅。
对于肺远端的功能而言,支气管肺泡连接处的通畅至关重要,这里是淋巴管和淋巴积聚的所在地,也是呼吸性细支气管的起始之处。覆盖呼吸性细支气管表面的表面活性物质来自肺泡,或在肺泡局部形成。杯状细胞的分泌取代了细支气管中的表面活性物质,会导致小气道变窄、阻力增加,甚至完全闭合。
最小气道内容物的清除主要依靠表面活性剂,因为气道内容物的运输不依赖纤毛器官。在纤毛上皮的功能区,由于表面活性剂的存在,支气管分泌物形成了致密层(凝胶层)和液体层(溶胶层)。
肺的表面活性系统参与氧气的吸收和调节氧气通过气血屏障的运输,以及维持肺微循环系统中最佳的过滤压力水平。
吐温会破坏表面活性剂膜,导致肺不张。相反,吸入卵磷脂化合物气雾剂则具有良好的治疗效果,例如,对于新生儿呼吸衰竭,因为在吸入羊水时,胆汁酸可能会破坏表面活性剂膜。
肺通气不足导致表面活性膜消失,塌陷肺通气的恢复并不伴随所有肺泡表面活性膜的完全恢复。
表面活性剂的活性特性在慢性缺氧条件下也会发生变化。在肺动脉高压中,表面活性剂的含量会减少。实验研究表明,支气管通畅度受损、肺循环静脉充血以及肺部呼吸表面面积减少,都会导致肺部表面活性剂系统活性降低。
吸入空气中氧气浓度升高,导致肺泡腔内出现大量成熟的表面活性物质和嗜锇小体的膜形成,这表明肺泡表面的表面活性物质遭到破坏。烟草烟雾对肺表面活性物质系统有负面影响。吸入空气中的石英、石棉粉尘和其他有害杂质会导致表面活性物质的表面活性降低。
据多位作者称,表面活性剂还能防止渗出和水肿,并具有杀菌作用。
肺部炎症过程会导致肺表面活性物质的表面活性特性发生变化,而这些变化的程度取决于炎症的活跃程度。恶性肿瘤对肺表面活性物质系统的影响更为显著。恶性肿瘤会导致肺表面活性物质的表面活性特性显著下降,尤其是在肺不张区。
有可靠数据显示,长时间(4-6小时)氟烷麻醉会导致肺表面活性物质的表面活性受到破坏。使用人工血液循环机的手术常常伴有肺表面活性物质系统的严重紊乱。此外,肺表面活性物质系统的先天性缺陷也是已知的。
表面活性剂可通过荧光显微镜形态学检测,因为其主要荧光形式为肺泡内壁的一层非常薄的荧光层(0.1 至 1 微米)。它在光学显微镜下不可见,并且当制剂用酒精处理时也会被破坏。
有观点认为,所有慢性呼吸系统疾病都与呼吸器官表面活性物质系统的质或量缺陷有关。



 [
[