习惯性流产 - 原因
最近審查:04.07.2025
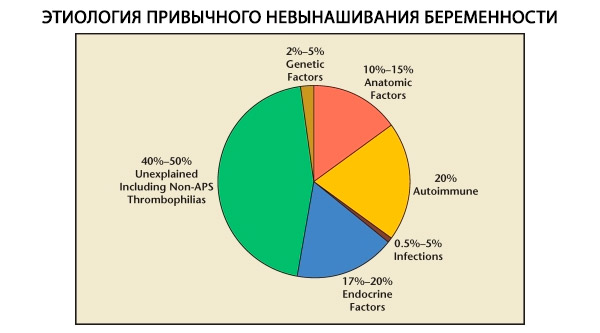
习惯性流产的构成因素包括遗传、解剖、内分泌、免疫和感染等。排除所有上述因素后,仍有一组患者的习惯性流产原因不明(特发性流产)。根据C. Coulam等人(1996年)的研究,80%的特发性流产是由未被发现的免疫疾病引起的。
没有令人信服的证据表明子宫内膜异位症会导致复发性流产,或者子宫内膜异位症的药物或手术治疗可以降低复发性流产的发生率。
根据目前的观点,除了遗传和部分感染因素导致胚胎异常形成外,其他因素(解剖、内分泌、免疫)的破坏作用也会导致基因完整的受精卵的发育处于不利状态,从而导致绒毛膜储备能力的耗尽和发育(胚胎发生)的停止。妊娠早期的关键时期被认为是6-8周(胚胎死亡)和10-12周(受精卵排出)。
 [ 1 ]
[ 1 ]
习惯性流产的遗传原因
遗传因素占习惯性流产的3-6%。在妊娠早期的偶发性终止妊娠中,约50%的流产与染色体异常有关。大多数(95%)的异常是染色体数目的变化——单体性(一条染色体缺失)、三体性(多一条染色体的存在),这是减数分裂错误的结果;以及多倍性(染色体组成增加一个完整的单倍体组),当一个卵子与两个或多个精子受精时就会发生。在偶发性流产中,最常见的是三体性——占所有突变的 60%(最常见于 16 号染色体,以及 13、18、21、22 号染色体),其次是 Shereshevsky-Turner 综合征(45 号染色体 X0)——20%,其余 15% 由多倍体(尤其是三倍体)引起。
如果流产导致染色体数目发生变化,父母的核型检查通常不会发现任何病变,且胎儿在后续妊娠中患染色体疾病的概率为 1%。相比之下,对有习惯性流产史的夫妇进行流产检查时,3-6% 的病例会观察到染色体结构变化(染色体内和染色体间)。检查父母的核型时,7% 的病例会发现染色体平衡重排。最常见的是相互易位,即一个染色体的某个片段位于另一个非同源染色体片段的位置,以及性染色体镶嵌、倒位和环状染色体的检测。如果配偶一方存在此类重排,减数分裂过程中染色体的配对和分离过程会受到阻碍,导致配子中染色体片段丢失(缺失)或加倍(重复)。这会导致所谓的不平衡染色体重排,胚胎要么无法存活,要么成为严重染色体病变的携带者。如果父母一方的核型存在平衡染色体重排,则生出患有不平衡染色体异常的孩子的概率为1-15%。数据差异与重排的性质、所涉及片段的大小、携带者的性别以及家族史有关。
诊断
病史
- 家庭成员患有遗传性疾病。
- 家族中存在先天性异常。
- 生下智力障碍儿童。
- 已婚夫妇或亲属出现不孕不育和/或原因不明的流产。
- 存在不明原因的围产期死亡病例。
特殊研究方法
- 对于已婚夫妇,如果生下有发育缺陷的新生儿,并且有流产史,以及在怀孕早期发生习惯性流产,则尤其需要对父母的核型进行研究。
- 死产或新生儿死亡情况下的流产细胞遗传学分析。
与其他专家会诊的指征
如果在父母身上检测到核型变化,则需要咨询遗传学家,以评估生下患有病理的孩子的风险程度,或在必要时决定捐献卵子或精子的问题。
患者的进一步管理
如果一对夫妇有病理核型,即使父母一方有,也建议在怀孕期间进行产前诊断 - 绒毛膜活检或羊膜穿刺术 - 因为胎儿发育障碍的风险很高。
习惯性流产的解剖原因
习惯性流产的解剖原因包括:
- 子宫发育的先天性异常(子宫完全双侧;双角子宫、马鞍形子宫、单角子宫;部分或完全宫内隔膜);
- 获得性解剖缺陷;
- 宫腔粘连(Asherman综合征);
- 粘膜下子宫肌瘤;
- 峡部颈部功能不全。
习惯性流产患者的解剖异常发生率为10%至16%。在所有子宫畸形中,可能导致流产(但不会导致不孕)的子宫畸形的发生率如下:双角子宫 - 37%、马鞍形子宫 - 15%、宫腔纵隔 - 22%、完全双子宫 - 11%、单角子宫 - 4.4%。
习惯性流产的诊断
病史
如果存在子宫解剖病理,则更常观察到晚期终止妊娠和早产,但是,如果植入宫内隔膜或肌瘤结附近,则也可能出现早期终止妊娠。
对于峡部宫颈机能不全,其特征性体征是妊娠中期自然终止妊娠或早产,这种现象发生得相对较快,且疼痛较小。
在子宫畸形的情况下,需要注意泌尿道病理的病史指征(通常伴随子宫先天性异常)和月经功能的发育性质(子宫残角功能正常的子宫出血指征)。
特殊考试方法
- 目前,子宫输卵管造影术用于确诊,可以研究宫腔形态,识别黏膜下子宫肌瘤、粘连和隔膜,并确定输卵管的通畅程度。为了诊断子宫病变,在月经和排卵期之间进行子宫输卵管造影术是合理的,即在月经周期的第一阶段,即血性分泌物停止后(月经周期的第7-9天)。为了诊断峡部型宫颈机能不全,应在月经周期的第二阶段(第18-20天)进行造影,以确定宫颈内口的状况。在进行子宫输卵管造影术之前,必须排除盆腔器官的炎症性疾病或进行相应的治疗。
- 近年来,宫腔镜检查已得到广泛应用,并已成为诊断宫内病变的金标准。然而,由于其费用高于子宫输卵管造影术,因此该方法仅用于根据初步超声数据判断宫内病变的女性。宫腔镜可用于检查宫腔,确定宫内病变的性质,并在具备必要设备(电切镜)的情况下,进行微创手术治疗,例如切除粘连、粘膜下肌瘤淋巴结和子宫内膜息肉。切除宫腔隔膜时,优先选择腹腔镜辅助的宫腔电切术,以预防子宫壁穿孔的可能性。
- 在月经周期的第一阶段进行超声波检查,可以初步诊断子宫粘膜下肌瘤和宫腔粘连;在月经周期的第二阶段,可以诊断宫腔隔膜和双角子宫。这种方法在妊娠早期尤为重要,其诊断这些疾病的敏感性为100%,特异性为80%。在妊娠期以外的阶段,诊断需要通过其他方法进一步确认。
- 国外学者指出,宫腔超声造影(使用经阴道探头进行超声检查,预先将0.9%氯化钠溶液注入宫腔)优于子宫输卵管造影,因为它可以鉴别宫腔纵隔和双角子宫。宫腔超声造影不仅可以研究宫腔形状,还可以确定宫底形态。在我国,这种方法尚未普及。
- 在一些复杂病例中,盆腔器官 MRI 检查可用于确诊。如果存在子宫发育异常,且伴有盆腔器官排列异常,该方法可提供宝贵的信息。MRI 检查对于判断是否需要切除残角子宫非常重要。如果残角子宫与输卵管和卵巢相连,则需要切除残角子宫,以防止受精卵在其中形成和发育。如果子宫解剖异常,终止妊娠可能与受精卵着床失败(在宫腔中隔,靠近粘膜下肌瘤结节)、子宫内膜血管形成和接受功能发育不良、宫腔空间位置过近(例如,由于肌瘤结节导致宫腔变形)、常伴有免疫组化 (ICI) 和激素紊乱有关。
习惯性流产的治疗
手术治疗
对于存在宫腔隔膜、粘膜下肌瘤结节和粘连的患者,最有效的手术治疗是宫腔镜手术。这类女性在治疗后流产的发生率为10%,而术前流产的发生率为90%。P. Heinonen(1997)比较了开腹手术和经宫颈宫腔镜手术的子宫成形术结果,结果表明宫腔镜手术创伤更小,疗效更佳;妊娠成功率分别为68%和86%。
手术切除宫腔隔膜、粘连和粘膜下肌瘤结节,可避免70%至80%的流产。然而,对于曾正常分娩但随后复发性流产的子宫畸形女性,该手术无效。在这种情况下,解剖因素可能并非主要原因,有必要寻找其他流产原因。
经腹子宫成形术已被证实存在术后不孕的显著风险,且不能改善后续妊娠的预后。因此,应优先考虑宫腔镜和腹腔镜手术。
药物治疗
宫内节育器植入、大剂量雌激素药物、宫腔内插入导尿管以移除粘连和宫腔隔膜的有效性尚未得到证实。建议在术后 3 个月内计划怀孕。为了促进子宫内膜生长,需要进行 3 个月经周期的周期性激素治疗 [14]。建议在周期的前 14 天服用 2 毫克 17-β-雌二醇,在接下来的 14 天服用 2 毫克 17-β-雌二醇和 20 毫克地屈孕酮(10 毫克地屈孕酮作为复方药物的一部分,加上 10 毫克地屈孕酮单独的片剂形式)。
患者的进一步管理
双角子宫或双子宫(有两个子宫腔)妊娠过程的特点:
- 在妊娠早期,由于明显的蜕膜反应,常常会出现从“空”的宫角或宫腔出血的情况;在这种情况下,应采取保守的策略,包括使用解痉药和止血药;
- 各个阶段终止妊娠的威胁;
- 峡部颈部功能不全的发展;
- 由于胎盘功能不全导致的宫内生长迟缓。
妊娠早期如有出血,宜卧床或半卧床休息,并服用止血药、解痉药、镇静药,以及孕激素治疗(地屈孕酮,每日剂量20至40毫克),直至妊娠16至18周。
习惯性流产的内分泌原因
据多位作者称,内分泌因素导致的流产占8%至20%。其中最主要的是黄体功能不全(LPD)、促黄体生成素(LH)分泌过多、甲状腺功能障碍和糖尿病。
严重的甲状腺疾病或糖尿病可能导致反复流产。然而,代偿性糖尿病患者发生习惯性流产的风险与一般人群并无差异。
同时,由于人群中甲状腺功能减退症的发病率较高,因此需要进行筛查并测量促甲状腺激素(TSH)水平。在习惯性流产患者中,20%-60%的患者存在黄体功能不全,44%-56%的患者超声检查显示多囊卵巢征象。文献报道,个体激素紊乱对习惯性流产症状形成的影响仍存在争议。M. Ogasawara等人(1997)的研究并未揭示,对于既往有两次或两次以上流产病史(排除自身免疫性、解剖学和感染性原因)的患者,在接受和未接受LPI治疗的情况下终止妊娠的频率是否存在可靠差异。
黄体功能不足可能是由许多不利因素造成的:
- 月经周期第一阶段 FSH 和 LH 分泌紊乱;
- LH 释放高峰过早或过晚;
- 由于卵泡生成不足而导致的雌激素水平低下。所有这些情况都无法通过在排卵后使用孕激素药物替代疗法来纠正。L. Regan 等人进行的前瞻性研究表明,与血液 LH 水平正常的女性相比,月经周期第 8 天 LH 分泌过多的患者流产率显著增加(分别为 65% 和 12%)。LH 分泌过早激增的损害作用与第二次减数分裂过早恢复和未成熟卵子的排卵有关,也与卵泡膜细胞在孕激素不足的影响下诱导雄激素分泌以及子宫内膜容受功能受损有关。然而,仅使用促性腺激素释放激素激动剂初步降低排卵前 LH 水平,而不采取旨在延长后续妊娠的额外措施,并不能达到预期的流产率降低效果。
诊断 NLF 的金标准是对 2 个月经周期中第二阶段的子宫内膜活检所获取的材料进行组织学检查。
必须诊断排卵功能障碍的其他原因,例如高催乳素血症、甲状腺功能减退症、雄激素功能过剩(卵巢或肾上腺),并开出适当的治疗方法。
诊断
病史和体格检查
- 病史。需要考虑的因素:月经初潮晚、月经周期不规律(月经稀发、闭经、体重突然增加、体重减轻、不孕症、习惯性早期流产)。
- 检查:体型、身高、体重、多毛症、第二性征的严重程度、有无条纹、乳腺检查有无溢乳。
- 功能诊断测试:在3个月经周期内测量直肠温度。
特殊研究方法
- 激素研究:
- 在月经周期的第一阶段(第7-8天)-测定FSH,LH,催乳素,TSH,睾酮,17-羟基孕酮(17-OP),DHEAS的含量;
- 在月经周期的第二阶段(21-22天)- 测定孕酮含量(孕酮水平的规范指标变化很大,如果不考虑其他因素,则不能使用该方法)。
- 超声波:
- 在月经周期的第一阶段(第5-7天)- 诊断子宫内膜病变,多囊卵巢;
- 在月经周期的第二阶段(20-21天)测量子宫内膜厚度(正常为10-11毫米,与孕酮含量相关)。
- 为确认NLF,应在预计月经来潮前2天(周期为28天,则为第26天)进行子宫内膜活检。此方法适用于诊断不明的情况。为了研究所谓“着床窗口期”子宫内膜的变化,应在排卵后第6天进行活检。
治疗
在诊断NLF时(根据直肠温度图表,第二阶段的持续时间少于11天,观察到温度逐渐升高,根据子宫内膜活检数据,子宫内膜分泌转化不足,血清中孕酮水平低),有必要确定此类疾病的原因。
如果NLF伴有高催乳素血症,则需进行脑部MRI检查。另一种方法是进行颅骨(鞍区)X光检查。
高催乳素血症的第一步是排除垂体腺瘤,垂体腺瘤需要手术治疗。如果没有显著变化,则考虑为功能性高催乳素血症,并开具溴隐亭治疗以使催乳素水平恢复正常。溴隐亭初始剂量为1.25毫克/天,持续2周,监测催乳素水平后,如果指标未恢复正常,则剂量增加至2.5毫克/天。如果催乳素水平显著升高,初始剂量为2.5毫克/天。如果妊娠,应停用溴隐亭。
如果确诊甲状腺功能减退症,应与内分泌科医生共同确定甲状腺病变的性质。无论如何,均需每日服用左甲状腺素钠治疗,剂量需根据个人情况选择,直至TSH水平恢复正常。如果怀孕,应继续服用左甲状腺素钠治疗。在获得激素检查结果(TSH水平、游离甲状腺素)后,应与内分泌科医生共同决定是否应在妊娠早期增加剂量。
纠正NLF有两种方法。第一种方法是刺激排卵,第二种方法是使用孕激素制剂进行替代疗法。
首选治疗方法是使用克罗米芬柠檬酸盐促排卵。这种方法基于以下事实:大多数黄体期疾病都发生在月经周期的卵泡期。第二期孕酮水平持续降低是由于月经周期第一期卵泡生成受损所致。在卵泡期早期使用小剂量克罗米芬柠檬酸盐比在月经周期第二期使用孕酮更能有效纠正这种疾病。
第一个周期,克罗米芬柠檬酸盐的剂量为50毫克/天,从月经周期的第5天开始服用至第9天结束。通过直肠温度图、周期第二阶段的孕酮水平测量或动态超声监测疗效。如果第二个促排卵周期疗效不佳,则应将克罗米芬柠檬酸盐的剂量增加至100毫克/天,从周期的第5天开始服用至第9天结束。第三个促排卵周期的最大剂量为150毫克/天。只有在药物耐受性良好(下腹部和腰背部无剧烈疼痛,且无其他卵巢过度刺激症状)的情况下,才可以增加剂量。
第二种治疗方案:孕酮制剂替代疗法。孕酮制剂可促进子宫内膜完全分泌转化,从而为排卵保留的习惯性流产患者提供必要的治疗效果。此外,近年来已证实,孕酮制剂不仅具有激素调节作用,还具有免疫调节作用,可抑制子宫内膜免疫活性细胞的排斥反应。特别是,已报道20毫克/天剂量的二氢孕酮具有类似的效果。替代疗法中,地屈孕酮口服剂量为20毫克/天,或微粒化孕酮阴道给药剂量为200毫克/天。治疗在排卵后第二天(即直肠温度升高的第二天)进行,持续10天。如果妊娠,应继续使用孕酮制剂治疗。
现代研究尚未证实人绒毛膜促性腺激素治疗复发性流产的有效性。
对于习惯性流产患者,如果出现雄激素过多症(卵巢或肾上腺原因),则需要药物治疗,因为雄激素会影响排卵的完整性和子宫内膜的状态。如果肾上腺雄激素的生物合成受到干扰,则可能对女性胎儿产生男性化作用,因此为了胎儿的利益,需要进行类固醇治疗。
卵巢发生雄激素过多症(多囊卵巢)
病史、体格检查和特殊检查结果
- 病史:月经初潮晚,月经周期紊乱,如月经稀发(通常为原发性,少数为继发性)。妊娠罕见,通常在妊娠早期自然中断,且两次妊娠之间长期不孕。
- 检查:多毛症、痤疮、妊娠纹、高体重指数(可选)。
- 直肠温度图表:无排卵周期与排卵和 NLF 周期交替。
- 激素检查:睾酮水平高,FSH和LH水平可能升高,LH/FSH比例大于3。超声波检查:多囊卵巢。
治疗
非药物治疗
减肥——饮食疗法、体育锻炼。
药物治疗
- 奥利司他,每次120毫克,随主餐服用。疗程持续时间需考虑疗效和耐受性。
- 使用含有醋酸环丙孕酮(2 毫克)和 EE(35 微克)的制剂进行初步睾酮减少,持续 3 个月经周期。
- 停止避孕,进行第二阶段的激素支持(孕激素疗法)——从月经周期第16天至第25天,每日服用20毫克地屈孕酮。如果没有自然排卵,则进入下一阶段。
- 从月经周期的第 5 天到第 9 天,以 50 毫克/天的初始剂量使用柠檬酸克罗米芬来刺激排卵,同时使用孕激素治疗(地屈孕酮,从月经周期的第 16 天到第 25 天,以 20 毫克/天的剂量使用)和地塞米松(0.5 毫克)。
- 若未妊娠,则克罗米芬枸橼酸盐的剂量应增至100-150毫克/天,并在周期第二阶段联合使用孕激素和地塞米松(0.5毫克)。已证实,尽管地塞米松仅能降低肾上腺雄激素水平,但克罗米芬枸橼酸盐联合地塞米松治疗的排卵和受孕率显著高于单独使用克罗米芬枸橼酸盐[12]。
- 进行三个周期的排卵刺激,之后建议在促孕支持下暂停三个月经周期,并决定通过腹腔镜手术进行治疗(卵巢楔形切除术、激光汽化术)。
患者的进一步管理
妊娠管理应联合孕激素支持治疗,直至妊娠16周(地屈孕酮20毫克/天或微粒化孕酮200毫克/天),地塞米松仅在妊娠早期使用。必须进行监测,以便及时诊断峡部型宫颈机能不全,并在必要时进行手术矫正。
肾上腺雄激素过多症(青春期和青春期后肾上腺生殖器综合征)
肾上腺生殖系统综合征(AGS)是一种遗传性疾病,由于负责合成多种酶系统的基因受损,导致肾上腺皮质激素合成障碍。该疾病为常染色体隐性遗传,由健康父母双方携带突变基因。
在 90% 的病例中,肾上腺生殖器综合征是由 CYP21B 基因突变引起的,导致 21-羟化酶合成中断。
病史、体格检查和特殊检查结果
- 病史:月经初潮晚,月经周期稍延长,可能月经稀发,孕早期自然流产,可能不孕。
- 检查:痤疮、多毛、机器人体型(宽肩、窄骨盆)、阴蒂肥大。
- 直肠温度图表:无排卵周期与排卵和 NLF 周期交替。
- 荷尔蒙测试:17-OP、DHEAS 水平高。
- 超声波检查:卵巢无变化。
妊娠之外的一个特征性症状是血浆中 17-OP 浓度的升高。
目前,促肾上腺皮质激素(ACTH)检测用于诊断潜伏性、非典型肾上腺雄激素增多症。该检测使用合成促肾上腺皮质激素(Synacthen),这是一种合成多肽,具有内源性促肾上腺皮质激素(ACTH)的特性,即它能够刺激肾上腺中胆固醇合成类固醇激素的初始阶段。
Synacthen 试验(促肾上腺皮质激素类似物):将 1 ml(0.5 mg)Synacthen 皮下注射至肩部,首先在清晨 9 小时采集血浆样本,测定 17-OP 和皮质醇的初始含量。注射后 9 小时采集对照血样,以测定 17-OP 和皮质醇的水平。然后使用以下公式计算测定指数 (D):
D = 0.052 × 17-OP + 0.005 × 皮质醇/17-OP - 0.018 × 皮质醇/17-OP
如果D系数小于或等于0.069,则表明不存在肾上腺雄激素过多症。如果D系数大于0.069,则应考虑肾上腺功能障碍引起的雄激素过多症。
药物治疗
21-羟化酶缺乏导致的高雄激素血症的主要治疗手段是糖皮质激素,用于抑制过量雄激素分泌。
患者的进一步管理
由于母体雄激素对胎儿具有男性化作用,且已确诊为肾上腺雄激素增多症,则应在妊娠前给予地塞米松治疗,初始剂量为0.25毫克,并在整个妊娠期间以个体化剂量(0.5至1毫克)持续用药。对于患有肾上腺雄激素增多症且发生习惯性流产的女性,不宜停止治疗,因为未治疗的流产率高达14%,持续治疗的流产率高达9%。
考虑到肾上腺生殖综合征患者可能会将这种基因遗传给胎儿,因此有必要进行产前诊断:在妊娠17-18周时,医生会进行血液检查,以确定母亲体内17-OP的含量。如果血液中的激素水平升高,则需要测定其在羊水中的浓度。如果羊水中17-OP的含量升高,则可以诊断胎儿患有肾上腺生殖综合征。遗憾的是,无法通过羊水中17-OP的水平来判断肾上腺生殖综合征的严重程度(轻度或重度失盐型)。在这种情况下,是否继续妊娠由父母决定。
如果孩子的父亲是肾上腺生殖综合征基因的携带者,并且家族中已有此类儿童出生,那么即使没有肾上腺雄激素过多症,患者也应为了胎儿的利益(防止女胎男性化)接受地塞米松治疗,剂量为20微克/公斤体重,最大剂量1.5毫克/天,饭后2-3次服用。在17-18周,确定胎儿的性别和肾上腺生殖综合征基因的表达情况(基于羊膜穿刺术的结果)后,如果胎儿是患有肾上腺生殖综合征的女孩,则治疗持续到妊娠结束。如果胎儿是男孩或女孩,但不是肾上腺生殖综合征基因的携带者,则可以停用地塞米松。
如果习惯性流产的妇女患有肾上腺雄激素增多症,则应在整个孕期进行地塞米松治疗,直至分娩后停药。产后第3天,地塞米松剂量逐渐减少(每3天减少0.125毫克),直至产后完全停药。
混合原因(卵巢和肾上腺)雄激素过多症
病史、体格检查和特殊检查结果
- 病史:月经初潮晚,月经周期紊乱,例如月经稀发(通常是原发性的,少数情况下是继发性的),闭经,可能受伤,脑震荡。罕见妊娠,通常在妊娠早期自然中断,两次妊娠之间长期不孕。
- 体格检查:多毛、痤疮、皮纹、黑棘皮症、体重指数高、高血压。
- 直肠温度图表:无排卵周期与排卵和 NLF 周期交替。
- 激素检查:睾酮水平高,FSH和LH水平可能升高,LH/FSH比例大于3,DHEAS、17-OP水平高,可能存在高催乳素血症。
- 超声波检查:多囊卵巢。
- 脑电图:大脑生物电活动的变化。
- 高胰岛素血症、脂质代谢紊乱(高胆固醇、低密度脂蛋白及极低密度脂蛋白)、糖耐量降低或血糖升高。
治疗
非药物治疗
减肥(低热量饮食、体育锻炼)。
药物治疗
第一阶段 - 在存在胰岛素抵抗的情况下,建议每日服用1000-1500毫克二甲双胍以增加胰岛素敏感性。
第二阶段 - 如果出现严重的月经周期紊乱和睾酮水平高,建议开具含有醋酸环丙孕酮(2毫克)和炔雌醇(35微克)的抗雄激素药物,持续3个月。
第三阶段是刺激排卵,然后进行孕激素支持(方案如上所述)并服用地塞米松,每日剂量为0.25-0.5毫克。
若出现高泌乳素血症和甲状腺功能减退症,应在促排卵周期进行适当的药物纠正。若妊娠,应停用溴隐亭,继续使用左甲状腺素。
如果促排卵无效,则应决定是否开具直接促排卵药物,以及是否进行多囊卵巢手术治疗或体外受精。
患者的进一步管理
代谢综合征患者妊娠常合并动脉高血压、肾病和高凝状态,因此需要从妊娠早期开始监测血压和止血情况,并(如有必要)使用抗高血压药物、抗血小板药物和抗凝药物来纠正可能出现的异常。孕激素在妊娠16周内有效,例如去甲孕酮,剂量为20毫克/天,或微粒化孕酮,剂量为200毫克/天,分两次服用。
所有雄激素血症女性均属于发生宫颈峡部功能不全的高危人群。应从妊娠第16周开始监测宫颈状况,必要时可进行宫颈峡部功能不全的手术矫正。
习惯性流产的免疫原因
目前已知,在所有无法解释的反复流产病例中(排除遗传、解剖和激素原因后),约80%与免疫疾病有关。导致习惯性流产的疾病包括自身免疫性疾病和同种免疫性疾病。
在自身免疫过程中,免疫系统自身组织会成为攻击的对象,即免疫反应针对自身抗原。在这种情况下,胎儿会因母体组织受损而遭受二次伤害。
在同种免疫性疾病中,女性的免疫反应是针对从父亲那里获得的胚胎/胎儿抗原,而这些抗原对于母亲的身体来说可能是外来的。
习惯性流产患者最常见的自身免疫性疾病包括血清中存在抗磷脂抗体、抗甲状腺抗体和抗核自身抗体。因此,已确定31%的妊娠期外习惯性流产女性存在抗甲状腺球蛋白和甲状腺过氧化物酶自身抗体(甲状腺微粒体[甲状腺过氧化物酶]自身抗体);在这些情况下,妊娠早期自然流产的风险增至20%。在习惯性流产中,抗核抗体和抗甲状腺抗体的存在提示需要进一步检查以确定自身免疫过程并明确诊断。
抗磷脂综合征(APS)仍然是一种被普遍认可的导致胚胎/胎儿死亡的自身免疫性疾病。
同种免疫性疾病
目前,导致胎儿排斥的同种免疫过程包括配偶体内主要组织相容性复合体系统的共同抗原数量增加(超过3种)(常见于近亲结婚);母亲血清中阻断因子水平低;在妊娠期间和妊娠外,母亲子宫内膜和外周血中自然杀伤细胞(NK细胞CD56、CD16)水平升高;子宫内膜和血清中多种细胞因子浓度高,特别是γ-干扰素、肿瘤坏死因子a、白细胞介素-1和2。
目前,导致早期流产的同种免疫因素及其纠正方法尚在研究中。治疗方法尚无共识。一些研究人员认为,使用供体淋巴细胞进行主动免疫不会产生显著效果,而另一些作者则认为,此类免疫和免疫球蛋白治疗可产生显著的积极效果。
目前,孕激素是妊娠早期的免疫调节剂之一。特别是,研究已证实,对于妊娠早期习惯性流产且子宫内膜CD56细胞水平升高的女性,每日服用20毫克地屈孕酮具有疗效。
 [ 11 ]、[ 12 ]、[ 13 ]、[ 14 ]、[ 15 ]、[ 16 ]
[ 11 ]、[ 12 ]、[ 13 ]、[ 14 ]、[ 15 ]、[ 16 ]
基因决定的血栓形成倾向
以下形式的遗传性血栓形成倾向被认为是妊娠期间的血栓形成状况,会导致习惯性流产。
- 抗凝血酶 III 缺乏。
- 因子V突变(莱顿突变)。
- 蛋白质 C 缺乏。
- 蛋白质 S 缺乏。
- 凝血酶原基因突变G20210A。
- 高同型半胱氨酸血症。
在以下情况下,需要进行检查以确定血栓形成倾向的罕见病因:
- 家族史——亲属中40岁前患过血栓栓塞症;
- 40岁之前发生过可靠的静脉和/或动脉血栓形成事件;
- 患者及直系亲属复发性血栓形成;
- 使用激素避孕药时怀孕期间和分娩后出现血栓栓塞并发症;
- 反复流产、死产、宫内生长迟缓、胎盘早剥;
- 早发性先兆子痫、HELLP 综合征。
习惯性流产的感染原因
感染因素在习惯性流产中的作用目前存在广泛争议。已知妊娠早期的原发性感染可能对胚胎造成不宜存活的损害,从而导致偶发性自然流产。然而,感染复发并导致反复流产的可能性微乎其微。此外,目前尚未发现诱发习惯性流产的微生物。近年来的研究表明,大多数习惯性流产合并慢性子宫内膜炎的女性子宫内膜中存在2-3种或更多种专性厌氧微生物和病毒。
VM Sidelnikova 等的研究显示,习惯性流产妇女中,73.1% 的病例经组织学检查确诊为妊娠期外慢性子宫内膜炎,86.7% 的病例在子宫内膜中观察到机会性微生物持续存在,这肯定是激活免疫病理过程的原因。混合持续性病毒感染(单纯疱疹病毒、柯萨奇病毒 A、柯萨奇病毒 B、肠道病毒 68-71、巨细胞病毒)在习惯性流产患者中的发生率明显高于有正常产史的女性。K. Kohut 等(1997)的研究表明,原发性习惯性流产患者子宫内膜和蜕膜组织炎症改变的百分比明显高于至少有过一次足月分娩的流产后女性。
细菌和病毒在子宫内膜的定植通常是由于免疫系统和机体非特异性防御机制(补体系统、吞噬作用)无法完全清除感染因子,同时T淋巴细胞(辅助性T细胞、自然杀伤细胞)和巨噬细胞的激活又限制了感染因子的扩散。在所有上述情况下,微生物都会持续存在,其特征是单核吞噬细胞、自然杀伤细胞和辅助性T细胞会合成各种细胞因子,并被吸引到慢性炎症部位。显然,子宫内膜的这种状态会阻止在植入前期形成局部免疫抑制,而这种免疫抑制对于形成保护性屏障并防止半异体胎儿的排斥至关重要。
因此,习惯性流产的女性在妊娠前应诊断为慢性子宫内膜炎。为了确诊或排除该病,应在月经周期第7-8天进行子宫内膜活检,并对宫腔组织进行组织学检查、PCR和细菌学检查。确诊后,应按照盆腔器官炎症疾病的治疗标准对慢性子宫内膜炎进行治疗。


