10 May 2024, 22:00
2024年4月29日,美国食品药品监督管理局(FDA)全面批准Seagen Inc.的组织因子(TF)靶向药物TIVDAK®(tisotumab vedotin),用于治疗化疗期间或化疗后病情进展的复发性或转移性宫颈癌患者。这代表了宫颈癌治疗领域的重大突破,凸显了抗体药物偶联物(ADC)在肿瘤学领域的潜力。
TIVDAK的作用机制
Tivdak 是一种针对 TF 的 ADC,它结合了 Genmab 的抗 TF 单克隆抗体 tisotumab 与 Seagen 的 ADC 技术,旨在针对癌细胞上的 TF 抗原并将细胞毒成分 MMAE 直接输送到癌细胞。
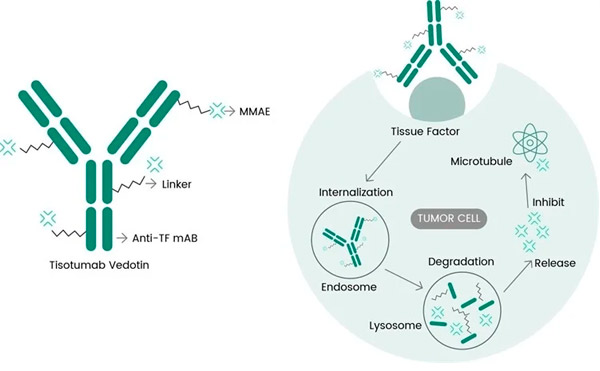
Tisotumab vedotin 的分子作用机制(https://doi.org/10.3390/ijms23073559)
TF:ADC开发的完美目标
TF已知参与肿瘤信号传导和血管生成,在绝大多数宫颈癌和许多其他实体瘤患者中过表达。TF与抗体结合后能够迅速被内化,且对正常凝血功能的影响极小,这进一步增强了其在癌症靶向治疗中的适用性。

