威斯塔研究所副教授 Filippo Veglia 博士及其团队发现了胶质母细胞瘤(一种严重且往往致命的脑癌)抑制免疫系统的关键机制,从而使肿瘤能够不受人体防御的阻碍而生长。
他们的研究成果发表在《免疫》杂志上,题为“葡萄糖驱动的组蛋白乳酸化促进胶质母细胞瘤中单核细胞衍生的巨噬细胞的免疫抑制活性” 。
维利亚博士说:“我们的研究表明,如果充分了解癌症的自我延续机制,就可以非常有效地对抗这种疾病。”
“我期待未来对胶质母细胞瘤中代谢介导的免疫抑制机制的研究,并希望我们能够继续了解更多关于如何更好地理解和对抗这种癌症的知识。”
到目前为止,关于单核细胞衍生的巨噬细胞和小胶质细胞如何在胶质母细胞瘤中创造免疫抑制肿瘤微环境的研究很少。
Veglia实验室研究了胶质母细胞瘤中免疫抑制的细胞机制,发现随着胶质母细胞瘤的进展,单核细胞衍生的巨噬细胞的数量开始超过小胶质细胞,这表明肿瘤微环境中单核细胞衍生的巨噬细胞的优势在免疫逃避方面对癌症有利。
确实,单核细胞衍生的巨噬细胞(而非小胶质细胞)在临床前模型和患者体内抑制了T细胞(杀死肿瘤细胞的免疫细胞)的活性。该团队通过评估人为减少单核细胞衍生巨噬细胞数量的临床前胶质母细胞瘤模型证实了这一点。
正如预期的那样,与标准胶质母细胞瘤模型相比,肿瘤微环境中恶性巨噬细胞较少的模型显示出更好的结果。
胶质母细胞瘤占所有脑部恶性肿瘤的一半以上,确诊患者的预后极差:仅有25%的患者在确诊后的第一年存活。胶质母细胞瘤的危险性不仅在于其位于脑内,还在于其免疫抑制性的肿瘤微环境,这使得胶质母细胞瘤对一些前景光明的免疫疗法产生了耐药性。
通过对某些免疫细胞(如巨噬细胞(单核细胞衍生的巨噬细胞和小胶质细胞)进行编程,使其为肿瘤发挥作用而不是对抗肿瘤,胶质母细胞瘤为自己创造了一个肿瘤微环境,使癌症能够积极生长,同时逃避抗癌免疫反应。
机制澄清
在证实了单核细胞衍生的巨噬细胞的作用后,韦利亚的实验室随后试图了解这些与癌症相关的免疫细胞究竟如何对抗免疫系统。
他们对巨噬细胞进行了测序,以确定细胞中是否有任何异常的基因表达模式,这些模式可能表明基因在免疫抑制中发挥作用,他们还检查了巨噬细胞的代谢模式,以查看异常基因表达是否与代谢有关。
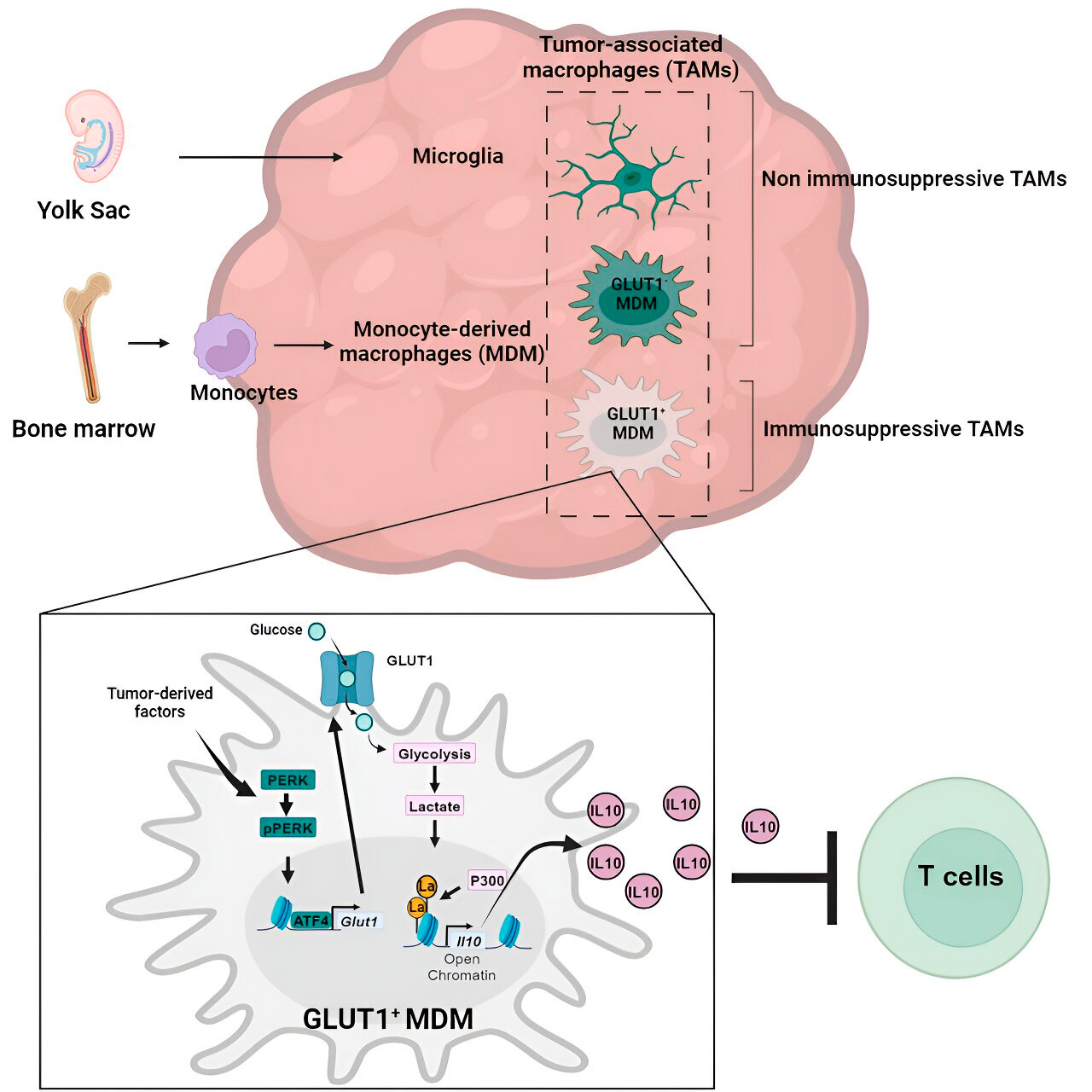
基因和代谢分析将它们引向葡萄糖代谢。一系列测试表明,葡萄糖代谢增强且主要葡萄糖转运蛋白GLUT1表达的单核细胞衍生巨噬细胞通过释放白细胞介素-10 (IL-10) 来阻断T细胞功能。
研究小组证明,胶质母细胞瘤会破坏这些巨噬细胞中的葡萄糖代谢,从而导致其产生免疫抑制活性。
组蛋白乳酸化及其作用
研究人员发现,单核细胞衍生的巨噬细胞葡萄糖代谢相关的免疫抑制活性的关键在于一个叫做“组蛋白乳酸化”的过程。组蛋白是基因组中的结构蛋白,在某些情况下对IL-10等基因的表达起关键作用。
单核细胞衍生的巨噬细胞通过快速代谢葡萄糖,产生乳酸,这是葡萄糖代谢的副产物。组蛋白可以发生“乳酰化”(即乳酸整合到组蛋白中),从而促进IL-10的表达,而IL-10由单核细胞衍生的巨噬细胞产生,以支持癌细胞的生长。
问题的解决方案
但是,如何才能阻止与葡萄糖代谢相关的单核细胞衍生巨噬细胞的免疫抑制活性呢?Veglia博士和他的团队找到了一个可能的解决方案:PERK,一种他们认为可以调节巨噬细胞中葡萄糖代谢和GLUT1表达的酶。
在胶质母细胞瘤的临床前模型中,靶向 PERK 可损害组蛋白乳酸化和巨噬细胞免疫抑制活性,而与免疫疗法相结合时,可阻止胶质母细胞瘤进展并诱导长期免疫,保护大脑免受肿瘤再生,这表明靶向 PERK-组蛋白乳酸化轴可能是对抗这种致命脑癌的可行策略。

