11 August 2025, 20:23
《自然通讯》杂志描述了一种用于治疗1型糖尿病的新型“氧气”植入物:一种紧凑型电化学氧气发生器 (iEOG) 持续向含有胰岛素分泌细胞的大胶囊供氧。该系统能够紧密填充分离的胰岛(浓度高达 60,000 IEQ/ml),即使在低氧条件下也能维持其活力和分泌。在患有糖尿病的大鼠中,皮下植入的装置可维持血糖正常长达三个月,且无需免疫抑制。对照组大鼠在没有氧气的情况下仍然处于高血糖状态。
背景
- 主要的技术问题是氧气。一旦我们将细胞“隐藏”在膜后,并将装置置于皮下(方便且易于取出),它们就会缺氧:通过膜和血管稀疏处的扩散无法满足“贪婪”胰岛的需求。因此,细胞会过早死亡,工作效率低下,并且需要大大减少接种量——否则胶囊会变得非常巨大。
- 为什么这在物理上如此困难?氧气在组织中传输的距离非常短,而且被囊化的细胞没有自己的血管——在最初的几个月里,它们只能依靠被动扩散存活。任何物质的增厚或细胞的“压缩”都会迅速导致囊的中心缺氧。
- 您之前尝试过什么?
- 他们制造了可充氧的大型装置(例如βAir):里面有一个储氧器,每天补充氧气;并进行了临床前和早期临床试验。这种方法有效,但对患者来说需要大量体力劳动。
- 人们尝试了化学氧气供体和“载体”材料(全氟化合物):它们虽然有效,但效果短暂且难以控制。此外,还出现了用于加速氧气输送到凝胶厚度的“空气”框架。
- 胶囊本身和植入部位(薄膜、前血管化)得到了改进,但由于没有外部 O₂ 源,它们仍然会遇到细胞密度限制。
- 这项新研究填补了哪些难题?《自然通讯》的作者展示了如何通过宏胶囊系统内部的微型发生器持续供应氧气:该装置从组织中吸收水分,并通过电化学方式释放氧气,氧气沿着胶囊均匀地与细胞“呼吸”。他们的想法是让胶囊拥有一个“专属的水族馆压缩机”,这样它就可以容纳更多细胞,并且即使在皮下这种“氧合”程度不高的地方,也能保证细胞的存活和工作。
这到底有什么必要呢?
胰岛或β细胞移植是实现1型糖尿病“功能性治愈”最有希望的途径之一。但目前存在两大障碍:
- 免疫力——通常需要终生服用免疫抑制剂;
- 缺氧——保护免疫系统的胶囊会同时切断细胞与血管的连接,而β细胞由于极度渴求氧气,会迅速“窒息”。这项新研究突破了第二道屏障:它为胶囊提供了自主控制的氧气来源。
植入物的工作原理
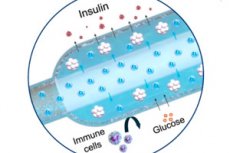
- 它由两部分组成。钛金属外壳内装有微型氧气发生器 (iEOG),可从组织液中提取水分,并通过电解释放氧气;旁边是一个细长的线状胶囊,胶囊内有细胞(类似于一根长“香肠”),一根透气管穿过胶囊:氧气沿着整个胶囊均匀吸收。细胞和组织之间有一层半透膜(电纺丝 + 海藻酸盐):葡萄糖和胰岛素可以通过,免疫细胞则无法通过。
- 尺寸:iEOG 第二版直径 13 毫米,厚 3.1 毫米,重约 2 克。与胶囊配合使用时,该系统可通过小切口插入和取出,这对于安全性至关重要。
- 生产效率。该发生器每小时可产生约1.9至2.3立方厘米的氧气,并能维持规定的流量达数月甚至数年(在生理盐水中进行的长期测试中,可达2.5年),且在植入大鼠体内后仍能维持这一水平。该流量经计算可满足数十万个胰岛当量的需求,相当于人体所需的数量级。
实验表明了什么
- 体外:在 1% O₂(严重缺氧)下,氧合维持了 INS-1 聚集体和填充在非常致密的层(60,000 IEQ/mL)中的人类胰岛的活力和分泌。
- 体内实验(大鼠)。iEOG 系统皮下植入同种异体糖尿病模型后,在长达 3 个月的时间内,无需免疫抑制即可使血糖恢复正常;无氧设备则无影响。发生器周围的组织学检查未显示任何显著不良反应。
为什么这对诊所很重要?
- 迈向“现实尺寸”的一步。为了向成人提供30万至77万IEQ的剂量,胶囊必须紧密填充——这一直以来都受到氧气的限制。可控的氧气供应“打破了”密度上限,使装置能够足够紧凑,以便真正植入。
- 更便捷。之前我们尝试过化学供氧剂(过氧化物),但它们作用时间短且难以控制,以及需要每天通过皮肤“补充”的氧气储存器,既麻烦又不方便。而这里,氧气可以持续定量供应,无需注射。
令人印象深刻的技术细节
- 水的来源是组织。iEOG 通过多孔的“窗口”吸入组织间液的蒸汽,然后使用经典的膜电极组件 (MEA) 和 1.4–1.8 V 的电压将水分离成 H₂ 和 O₂,并通过不同的通道将气体排出。
- 耐久性。三种装置在生理盐水中以直流电运行 11 个月、2 年后和 2.5 年,且不会因氧气流而出现性能下降;植入免疫缺陷和免疫功能正常的大鼠体内后,性能均得以维持。
局限性和“下一步”
这仍处于临床前阶段:大鼠、胶囊内的高密度、氧气供应——一切都很好,但关键测试还在后面:
- 适应人类剂量和时间范围;
- 多年来,电化学家一直在研究人体内的可靠性和电源(文章中没有详细介绍电源架构);
- 尽量减少囊周围的纤维化和扩散稳定性;
- 在β干细胞和更接近人类的模型上进行测试。作者公开地将他们的解决方案与之前的方法进行了比较,并将其定位为可临床转化的胶囊平台。
结论
为了使移植的β细胞能够在没有免疫抑制剂的情况下存活和发挥作用,它们需要呼吸。康奈尔大学及其合作伙伴团队证明,内置于线性胶囊中的微型氧气发生器可以足够长时间、均匀地为细胞“喂养”氧气,使它们能够承受高浓度氧气,即使在皮下也能降低血糖。临床应用尚需时日,但其工程逻辑简单而优美——在细胞缺氧的地方提供氧气。

