根据发表在《细胞干细胞》杂志上的一篇论文,人类干细胞可以自发形成视网膜组织,视网膜是眼睛中赋予我们视觉功能的组织。未来,移植这种3D组织或将帮助视力障碍患者。
“这是再生医学下一阶段的重要里程碑,”该研究负责人、日本理化学研究所发育生物学中心器官发生和神经发生组主任、医学博士、哲学博士Yoshiki Sasai教授说道。“我们的方法为利用源自人类干细胞的复杂组织进行治疗,以及与发病机制和药物开发相关的医学研究开辟了新的视角。”
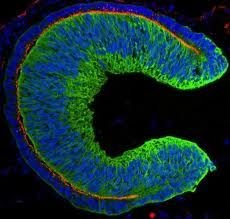
在发育过程中,视网膜——位于眼球内部的感光组织——由一种被称为视杯的结构形成。在日本研究人员的新研究中,该结构是由人类胚胎干细胞(hESC)自发形成的。hESC是源自人类胚胎的细胞,具有分化成多种组织的潜力。这得益于笹井教授及其团队优化的细胞培养技术。
人类胚胎干细胞(HESC)衍生的细胞组成规则的三维结构,其视杯分为两层,其中一层含有大量感光细胞,称为光感受器。由于视网膜变性主要由光感受器损伤引起,因此人类胚胎干细胞衍生的组织可能是理想的移植材料。
日本科学家的研究不仅为干细胞在再生医学中的应用开辟了新的前景,而且必将加速发育生物学等自然科学领域的发展。在实验中,研究人员发现,由人类胚胎干细胞形成的视杯比由小鼠胚胎干细胞培养的视杯厚得多。此外,它同时包含视杆细胞和视锥细胞,而在小鼠胚胎干细胞培养中很少观察到视锥细胞的分化。这意味着胚胎细胞携带了特定物种的指令,用于构建这种眼部结构。
笹井教授表示:“我们的研究为理解人类特有的、以前无法研究的眼睛发育特征开辟了道路。”

这并非笹井教授团队的首次重大成功。去年年底,科学家们利用小鼠胚胎干细胞培育出功能性垂体前叶(腺垂体),该细胞由几种不同类型的激素分泌细胞组成。一篇关于这项研究成果的文章《在三维培养中自主形成功能性腺垂体》已发表在《自然》杂志上。
脑垂体是位于大脑底部的一个小型内分泌腺,负责分泌多种重要激素。它在早期发育过程中尤为重要,能够在实验室中模拟其形成过程将有助于科学家更好地理解胚胎发生。脑垂体异常与巨人症等生长障碍以及包括失明在内的视力问题有关。
如果没有3D细胞培养,这项实验是不可能实现的。脑垂体是一个独立的器官,但它的发育需要来自其正上方大脑区域——下丘脑的化学信号。在3D培养中,科学家们能够同时并排培养两种类型的组织,最终产生的干细胞在两周后自组织形成脑垂体。
荧光染色显示,培养的垂体组织表达了相应的生物标志物,并分泌了垂体前叶典型的激素。研究人员更进一步,将合成的垂体器官移植到缺乏垂体的小鼠体内,以测试其功能。实验取得了成功:生物工程垂体恢复了小鼠血液中的糖皮质激素水平,并消除了嗜睡等行为症状。而植入干细胞结构的小鼠由于没有接触必要的信号因子,因此无法发育成功能性垂体,因此情况并未改善。
笹井教授和他的同事计划在人类干细胞上重复这项实验,他们相信这项工作至少需要三年时间。



 [
[